Das Periodensystem, eine geniale Erfindung der Natur

Das Periodensystem ist ein faszinierendes Ordnungssystem, das die Natur den Elementen gegeben hat. Der russische Chemiker Dimitri Mendelejew und der deutsche Chemiker Lothar Meyer haben dies unabhängig voneinander fast zeitgleich in den 1860er Jahren erkannt. Beide haben ihre Erkenntnisse Jahr 1869 in einer wissenschaftlichen Zeitschrift veröffentlicht.
Damals waren noch längst nicht alle Elemente bekannt, doch aufgrund der vorhandenen „Lücken“ im Periodensystem konnte die Existenz weiterer noch nicht entdeckter Elemente vorhergesagt werden. So wurde z.B. ein Element "Eka-Silicium" postuliert, das im Periodensystem unter dem Element Silicium stehen sollte. Es war eine großartige Bestätigung des Periodensystems, als "Eka-Silicium", das inzwischen Germanium heißt, später auch entdeckt wurde und seine chemischen und physikalischen Eigenschaften den Vorhersagen verblüffend genau entsprachen.
Wie das Periodensystem aufgebaut ist, steht weiter unten auf dieser Seite. Noch weiter unten findet ihr eine Liste mit Beiträgen zu einzelnen Elementen, die hier auf FaszinationChemie veröffentlicht sind. Außerdem gibt's hier auch das Periodensystem als Rockmusik.
Abbildungen:
oben: Kupfer (Alchemist-hp; Cu-Scheibe, CC BY-SA 3.0 DE)
Mitte: Brom (K. Sonnenberg, FU Berlin).
unten Bismut (Michael Ruck, TU Dresden)
Wie entstand das Periodensystem?
Die Geschichte der Entdeckung des Periodensystems, von der Antike bis zu den bei der Gesellschaft für Schwerionenforschung (GSI) in Darmstadt entdeckten künstlichen Elementen zeigt dieses Video aus dem Jahre 2010. Einige der letzten entdeckten Elemente fehlen hier noch.
Die Entdeckung der Elemente in 99 Sekunden
In welchem Jahr wurde welches Element entdeckt? Das zeigt auch das Video 300 years of element discovery in 99 seconds von Jamie Gallagher. Auch hier erkennt man die Lücke für das oben erwähnte "Eka-Silicium", die später mit Germanium gefüllt wurde. Die Jahreszahlen der Entdeckung der einzelnen Elemente können von dem obigen Video der GSI etwas abweichen, weil zwischen Entdeckung und offizieller "Anerkennung" und Namensgebung eines Elementes einige Jahre vergehen können.
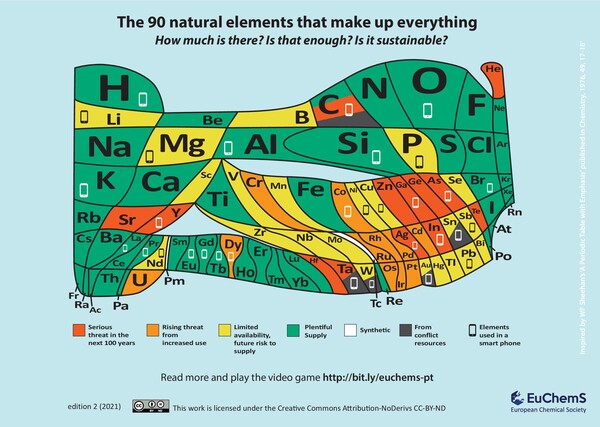
Das etwas andere Periodensystem
In diesem Periodensystem, entwickelt von der European Chemical Society ist mit verschiedenen Farben die Verfügbarkeit der Elemente dargestellt. Das Smartphone-Symbol kennzeichnet Elemente, die in einem handelsüblichen Smartphone verbaut ist und die graue Farbe zeigt Elemente an, die unter fragwürdigen Bedingungen gewonnen werden, also in Ländern, in denen Krieg herrscht und/oder Kinderarbeit üblich ist.
Struktur des Periodensystems









Im Periodensystem der Elemente werden alle chemischen Elemente nach steigender Kernladungszahl sortiert: von Wasserstoff mit der Ordnungszahl 1 bis zum schwersten heute bekannten Element, dem Organesson (Ordnungszahl 118). Die Kernladungszahl, auch Ordnungszahl genannt, definiert die Anzahl der Protonen, der positiv geladenen Teilchen in einem Atom. Wasserstoff hat also ein Proton, Organessum hat 118 Protonen. Diese Reihe der 118 Elemente wird in mehreren Zeilen dargestellt, die als Perioden bezeichnet werden. Die Elemente, die dadurch im Periodensystem untereinander, also in einer Spalte stehen, bilden eine Gruppe. Das Periodensystem hat 18 Gruppen, von denen acht als Hauptgruppen bezeichnet werden.
Nach dem Bohr’schen Atommodell besteht ein Atom aus einem Kern, der die positiv geladenen Protonen und ungeladene Neutronen enthält und einer Hülle, die die negativ geladenen Elektronen enthält. Bei einem elektrisch ungeladenen Atom muss die Anzahl von Protonen und Elektronen immer gleich sein. Da die Ordnungszahl und damit die Anzahl der Protonen im Periodensystem von links nach rechts und von Reihe zu Reihe zunehmen, steigt auch die Anzahl der Elektronen. Nach einer sehr einfachen, doch für das Verständnis des Periodensystems sehr hilfreichen Vorstellung, besteht die Hülle eines Atoms aus verschiedenen Bahnen, auch „Schalen“ genannt, die unterschiedlich viele Elektronen aufnehmen können. Diese Schalen liegen wie die Schalen einer Zwiebel um den Atomkern.
In der ersten Periode stehen die leichtesten beiden Elemente Wasserstoff und Helium mit einem bzw. zwei Protonen und Elektronen. Dabei befinden sich die Elektronen in der innersten Schale, die als K-Schale bezeichnet wird. Sie kann nicht mehr als zwei Elektronen aufnehmen. In der zweiten Periode stehen die Elemente, in denen zusätzlich zur K-Schale auch die sogenannte L-Schale mit insgesamt acht Elektronen aufgefüllt wird, so dass das schwerste Element der 2. Periode insgesamt zehn Protonen und Elektronen enthält. In der 3. Periode beginnend mit dem Element Natrium, wird eine weitere Schale, die M-Schale mit acht Elektronen aufgefüllt. Das schwerste Element der 3. Periode, das Argon, hat also 18 Protonen und Elektronen und damit die Ordnungszahl 18.
Ab der vierten Periode wird zwischen die 2. Hauptgruppe (Calcium, Ordnungszahl 20) und die 3. Hauptgruppe (Gallium, Ordnungszahl 31) ein Block von 10 Nebengruppenelementen mit den Ordnungszahlen 21 bis 30 eingeschoben. In diesem wird nicht wie bisher die äußerste Schale, sondern die zweitäußerste Schale, die jeweils 10 Elektronen aufnehmen kann, aufgefüllt. Wenn diese Schale vollständig gefüllt ist, wird ab dem Element Gallium wieder die äußerste Schale aufgefüllt. Ab der sechsten Periode wird auch der Block der Nebengruppenelemente noch einmal unterteilt, indem jeweils 14 Elemente eingeschoben werden. In diesen Elementen, die als Lanthanoide und Actinoide bezeichnet werden, wird die drittäußerste Schale mit jeweils 14 Elektronen aufgefüllt, bevor dann weiter die zweitäußerste Schale der Nebengruppen und dann die äußerste Schale der Hauptgruppe gefüllt werden.
Das Periodensystem ist nun so eingeteilt, dass Elemente mit der gleichen Anzahl von Elektronen in der äußersten Schale untereinander stehen und eine Gruppe bilden. Da die Anzahl der Elektronen in der äußersten Schale, der sogenannten Valenzelektronen, die Eigenschaften der Elemente wesentlich beeinflussen, haben die Elemente einer Gruppe auch ähnliche Eigenschaften. Dadurch konnten Mendelejew, Meyer und andere Wissenschaftler die Existenz noch unbekannter Elementen voraussagen.
Fotos von oben nach unten:
Kohlenstoff (Diamant, Mario Sarto, Diamant tropfen, CC BY-SA 3.0)
Gold (Rob Lavinsky, iRocks.com – Gold-t06-90a, CC BY-SA 3.0)
Indium (Dschwen, Indium wire, CC BY-SA 3.0)
Caesium (Constantin Hoch, TU München)
Yttrium (Alchemist-hp, FAL, via Wikimedia Commons)
Schwefel (James Shook (=JShook), Sulpherous fumeroles, CC BY-SA 3.0)
Molybdän (Alchemist-hp (talk) [FAL or GFDL 1.2], via Wikimedia Commons)
Nickel (René Rausch, Nickel kugeln, CC BY-SA 3.0 DE)
Quecksilber (Bionerd, Pouring liquid mercury bionerd, CC BY 3.0)
Ausgewählte Elemente des Periodensystems
Auf der Seite der Gesellschaft Deutscher Chemiker, die 2019 zum Jahr des Periodensystems eingerichtet wurde, findet sich ein interaktives Periodensystem. Zu allen bunt dargestellten Elementen gibt es weitere Informationen.
Folgende Elemente werden in der Rubrik Wissen und Fakten hier bei FaszinationChemie.de beschrieben:
Wasserstoff: Das Element Nummer 1
Natrium – das Salz in der Suppe
Caesium – das unedle Gold
Beryllium, das Supergift?
Magnesium – das vielseitige Leichtmetall
"Ja Kalzium, das ist alles!" (Calcium)
Yttrium – kaum bekannt aber viel genutzt
Von Pancromium über Eritronium zum Vanadium
Molybdän: Zäh und lebenswichtig, aber nicht offensichtlich
Mangan – Stahlhart und doch essentiell für das Leben
Technetium – Ein künstliches Element macht Karriere im Krankenhaus
Rhenium – ein patriotisches Chamäleon
Eisen – Universalmetall der modernen Menschheit
Rhodium – aus keinem Autokatalysator wegzudenken
Nickel – nicht nur ein Legierungsbestandteil
Palladium – der Star unter den Katalysatoren
Sepia, Sonnenbräune und Stromkabel – Kupfer ist überall!
Gold – viel mehr als Schmuck und Zahlungsmittel
Zink – Ein universelles Metall
Quecksilber – vergöttert und verteufelt
Bor: Das fünfte Element – kleiner Nachbar von Kohlenstoff?
Gallium: Cluster, Licht und Neutrinos
Indium – selten und wichtig
Kohlenstoff - King of the Elements
Silicium – Eine kurze Geschichte der Menschheit
Germanium – mehr als nur ein Lückenfüller
Zinn – von Mysterien zu Ungewöhnlichem
Blei – Untergang der Römer und Solarzellen der nächsten Generation?
Stickstoff – unverzichtbar für Mensch, Tier und Pflanze
Phosphor – mehr als Bomben, Kampfstoff und Pestizide
Arsen – Medikament und „Erbschaftspulver“
Antimon – unscheinbar und doch allgegenwärtig
Wißmad Ärcz, Bisemutum, Wismut, Bismut
Sauerstoff – das Element des Lebens
Schwefel: Ringe, Ketten, Farben
Tellur – vom paradoxen Gold zum Gewürzmetall
Chlor, ein „janusköpfiges“ Element
Brom, eines von zwei flüssigen Elementen
Iod – Das Veilchenfarbene
Xenon und weitere Edelgase – die fehlenden Bausteine im Periodensystem

Dr. Karin J. Schmitz
Leiterin GDCh-Öffentlichkeitsarbeit




Kommentare
HPS
am 06.10.2024