Gallium: Cluster, Licht und Neutrinos

Die Existenz eines höheren Homologen des Elements Aluminium wurde sowohl von D. Mendelejeff [1] als auch von L. Meyer [2] in ihren ersten Veröffentlichungen 1869/1870 über das Periodensystem der Elemente vorhergesagt. Dem französischen Chemiker Lecoq de Boisbaudran gelang es kurz darauf als Erstem, das von Mendelejeff und Meyer als Eka-aluminium bezeichnete Element in reiner Form durch Elektrolyse einer ammoniakalischen Galliumsulfatlösung an einer Platinelektrode darzustellen. [3] Zu Ehren seines Vaterlandes gab Lecoq de Boisbaudran dem neu dargestellten Element den Namen Gallium.
Herstellung und Eigenschaften
Da Gallium nicht in „eigenen“ Mineralien vorkommt, aus denen es preiswert gewonnen werden könnte, blieb es bis 1915 unbeachtet. Erst als F. G. McCutcheon Ausschwitzungen von bleihaltigen Rückständen einer zweifach durchgeführten Zinkdestillation als stark Gallium- und Indium-haltig erkannte, [4] wurde eine neue Gallium-Quelle erschlossen, die jedoch mit der Einstellung des Verfahrens der zweifachen Zinkdestillation wieder versiegte. Heute wird Gallium vor allem bei der Aluminiumherstellung als Nebenprodukt erhalten [5] und auch das Recycling wird immer wichtiger, vor allem da der Bedarf an Gallium durch die aktuellen Entwicklungen im Bereich der Halbleitertechnik (siehe unten) immer größer wird.
Aufgrund der schlechten Verfügbarkeit und des dadurch resultierenden hohen Preises war das Interesse an dem Element Gallium und seiner Chemie – auch im industriellen Bereich – lange Zeit gering. Außerdem reihten sich die Eigenschaften der Verbindungen des Galliums in die typische Chemie der Elemente der III. Hauptgruppe des Periodensystems ein. Deshalb waren wenig Überraschungen zu erwarten, und somit beschäftigten sich die Chemiker eher mit den Besonderheiten der leichteren und schwereren Homologen des Galliums. [6] In Lehrbüchern ist diese Eigenschaft durch den Satz gekennzeichnet: „Gallium zeigt in seinem chemischen Verhalten große Ähnlichkeit mit dem leichteren Gruppenhomologen, dem Aluminium. [5] Tatsächlich sind sowohl die Ionen- als auch die Kovalenzradien beider Elemente sehr ähnlich. Gallium nimmt jedoch durch seine Stellung im Periodensystem als erstes Element mit abgeschlossener d-Schale eine Sonderstellung ein. So gehört Gallium zu den Elementen mit den größten Flüssigkeitsbereichen (30 – 2300°C) und weist als Metall im Gegensatz zu Aluminium eine ungewöhnliche Vielzahl an Elementstrukturen auf, in denen zum Teil molekulare Strukturen ausgebildet werden (Abbildung 1). So findet man zum Beispiel in der Normaldruckmodifikation a-Ga kurze Ga-Ga-Abstände von 245 pm und eine Koordinationszahl der Galliumatome von sieben (1+2+2+2) weshalb a-Ga auch gerne als molekulares Metall mit Ga2 Hanteln beschrieben wird.
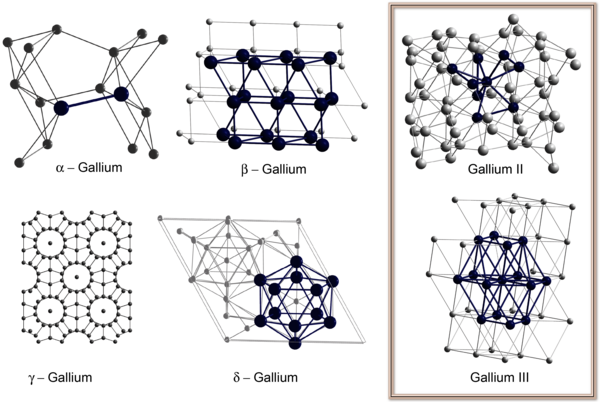
Trotz dieser molekularen Strukturen besitzt elementares Gallium eine zu elementarem Eisen vergleichbar hohe elektrische Leitfähigkeit. Beim Schmelzen tritt ähnlich dem Silizium eine Volumenkontraktion auf und flüssiges Gallium neigt zur Unterkühlung, d.h. flüssiges Gallium bleibt auch für längere Zeit bei Raumtemperatur flüssig (Abbildung 2). Legierungen mit Aluminium sind aufgrund der Schmelzpunkterniedrigung bei Raumtemperatur flüssig und können z.B. als Sperrflüssigkeit eingesetzt werden. Die in den Elementmodifikationen gefundenen Strukturmotive finden sich auch im Bereich metallreicher metalloider Clusterverbindungen (siehe unten).

Technische Anwendungen
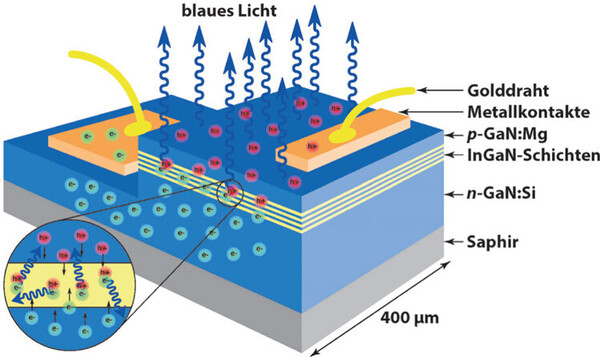
Mit der Entdeckung der Halbleitereigenschaften der Verbindungen des Typs GaE (E = N, P, As, Sb) nahm das Interesse an der metallorganischen Chemie des Galliums stetig zu, da sich diese Verbindungen als Ausgangsmaterialien in MOCVD Verfahren (metallorganische chemische Gasphasenabscheidung) zur Synthese von technisch wichtigen Halbleitermaterialien einsetzen lassen. So sind Galliumnitrid(GaN)-basierte Materialien (Abbildung 3) die Basis für die blaue Leuchtdiode (kurz LED von light emitting diode) und 2014 wurden Isaamu Akasaki, Hiroshi Amano und Shuji Nakamura für die bahnbrechende Entwicklung dieser LED‘s mit dem Nobelpreis für Physik ausgezeichnet.
Eine weitere Besonderheit von Gallium ist, dass das 71Ga Isotop mit Sonnenneutrinos zu 71Ge reagieren kann, ein Umstand, der zum Nachweis des Neutrinoflusses in zwei Großexperimenten (GALLE[9]und SAGE 10] ausgenutzt wurde. Bei diesen Experimenten kam es dabei zur größten Anhäufung von Gallium; so wurde für GALLEX 30.3 Tonnen und für SAGE ca. 30 Tonnen Gallium verwendet. Die Isolierung der wenigen Germaniumatome aus dem riesigen Überschuss an Galliumatomen gelang unter Ausnutzung der unterschiedlichen Eigenschaften der Chloride.
Ungewöhnliche Oxidationsstufen
All die bisher beschriebenen Entwicklungen sind auf die Chemie des dreiwertigen Galliums beschränkt, obwohl bereits Lecoq de Boisbaudran darauf hinwies, dass Galliumhalogenide stabile Verbindungen in niedrigen Oxidationsstufen (< 3) bilden. [11] Herstellen lassen sich die Halogenide in der Oxidationsstufe +2 durch Reaktion von GaX3 mit elementarem Gallium im Rahmen einer Komproportionierungsreaktion. Auch hier offenbart Gallium ungewöhnliche Eigenschaften. So sind die Halogenide der formalen Oxidationsstufe +II z.B. Ga2Cl4 gemischtvalent, d.h. aus Ga+ und GaCl4- aufgebaut. Ausgehend davon lassen sich jedoch durch Reaktion mit Lewis Basen Ga(II) Verbindungen wie LGaCl2-GaCl2L (L = Dioxan) mit direkter Ga-Ga Bindung erhalten. Eine einfache Variante zur Herstellung von Monohalogeniden wurde von Green et al. vorgestellt. [12] So reagiert flüssiges Gallium mit einem Äquivalent Iod in Toluol im Ultraschall bei ca. 35°C zu formalem `GaI`, welches jedoch keine einheitliche Verbindung, sondern eine Mischung verschiedener subvalenter Halogenide ist.
Aktuelle Forschung
Monohalogenide des Galliums lassen sich bei hohen Temperaturen und niedrigen Drücken durch Komproportionierung (2Ga + GaX3 → 3GaX; X = Cl, Br, I) herstellen und werden als metastabile Lösungen durch Kokondensationstechnik erhalten. Ausgehend davon konnten Schnöckel et al. einen Synthesezugang zu nanoskaligen metalloiden Clusterverbindungen der allgemeinen Zusammensetzung GanRm (n>m; R = sterisch anspruchsvoller Substituent) eröffnen. [13] Auch hier kommen die besonderen Eigenschaften des Galliums zum Tragen, d.h. auch in der Topologie der Galliumatome der Clusterverbindungen spiegelt sich die Vielfalt der möglichen Elementstrukturen wieder. So findet man beispielsweise in der metalloiden Clusterverbindung {Ga84[N(SiMe3)2]20}4- Strukturmotive von gleich zwei Normaldruckmodifikationen α- und δ-Ga (Abbildung 4).[14]
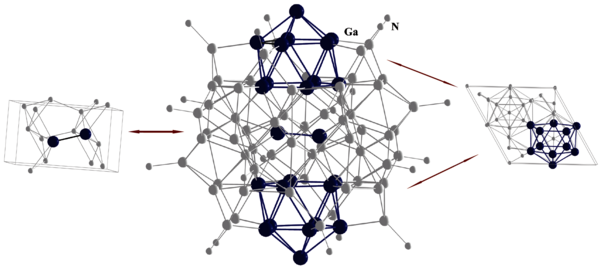
Außerdem zeigt sich, dass je nach Substituentenhülle und Anzahl an Galliumatomen in den metalloiden Clusterverbindungen die Anordnung der Galliumatome Normal- oder auch Hochdruckmodifikationen ähnelt. Die in den metalloiden Clusterverbindungen gefundenen Strukturen eröffnen somit erstmals einen Einblick in den nanoskaligen Grenzbereich bei Metallen – ein Bereich der aktuell durch Entwicklungen der Nanotechnologie auch immer mehr technische Relevanz gewinnt., D.h. hier öffnet sich erstmals ein Fenster zu den molekularen Vorgängen der technisch extrem wichtigen und einfach erscheinenden Prozessen der Bildung (Reduktion) oder des Auflösens (Oxidation) von Metallen.
Trotz oder vielleicht gerade aufgrund seiner besonderen Eigenschaften eröffnet das Element Gallium hier neue Wege und ist aktuell wegen seiner zentralen Bedeutung für III/V Halbleitermaterialien auch für die Technik z.B. im Bereich der LED‘s essentiell.
Literatur
D. Mendelejeff, J. Russ. Ges., 1869, 1, 76.
L. Meyer, Lieb. Ann. Suppl., 1870, 7, 356.
F. Lecoq de Boisbaudran, Compt. rend., 1875, 81, 493
W. F. Hillebrand, J. A. Scherrer, J. ind. eng. Chem., 1916, 8, 225
Holleman, Wiberg, Lehrbuch der Anorganischen Chemie, 101. Verbesserte und stark erweiterte Auflage von N.Wiberg, Walter de Gruyter, Berlin, 1995
A. R. Barron, A. N. McInnes, Encyclopedia of Inorganic Chemistry (Ed.: R. B. King), 1994, John Wiley, New York.
O. Schulte, W. B. Holzapfel, Phys. Rev. B 1997, 55, 8122 – 8128.
P. von Dollen, S. Pimpuktar, J. S. Speck, Angew. Chem. 2014, 126, 14198 – 14200; Angew. Chem. Int. Ed. 2014, 53, 13978 – 13980.
W. Hampel et al. Phys. Lett. B, 1996, 388, 384 – 396.
J. N. Abdurashitov et al. Phys. Rev. C, 1999, 60, 055801-1 – 055801-32.
Gmelin, Handbuch der Anorganischen Chemie, 1936, 36, Gallium.
M. L. H. Green, P. Mountford, G. Smout, S.Speel, Polyhedron, 1990, 22, 2763 – 2765.
A. Schnepf, H. Schnöckel, Angew. Chem. 2002, 114, 3682 – 3704; Angew. Chem. Int. Ed. 2002 41, 3532 – 3554.
A. Schnepf, H. Schnöckel, Angew. Chem. 2001, 113, 734 – 737; Angew. Chem. Int. Ed. 2001, 40, 712 – 715.

Prof. Dr. Andreas Schnepf
Institut für Anorganische Chemie Universität Tübingen
Das Periodensystem ist ein faszinierendes Ordnungssystem, das die Natur den Elementen gegeben hat. Vor 150 Jahren wurde dieses System erstmals von Wissenschaftlern erkannt. Die Generalversammlung der Vereinten Nationen und die UNESCO haben das Jahr 2019 daher zum International Year of the Periodic Table of Chemical Elements, dem Internationalen Jahr des Periodensystems ausgerufen. Die Elemente des Periodensystems werden in loser Folge vorgestellt.
Dieser Beitrag wurde auf FaszinationChemie erstmalig veröffentlicht am 20.05.2019

Kommentare
Keine Kommentare gefunden!