Bor: Das fünfte Element – kleiner Nachbar von Kohlenstoff?

2019 – Jahr des Periodensystems
Bor, B, führt scheinbar ein Nischendasein, wenn man vielleicht davon absieht, dass gleich mehrere Bor-Chemiker den Nobelpreis erhalten haben: William Lipscomb, Herbert C. Brown und Roald Hoffmann. Das Element mit der Ordnungszahl fünf ist zwar ein essentieller Baustein von Materialien, ohne die man keine modernen Windräder bauen würde (aus Nd2Fe14B bestehen beispielsweise die stärksten Magnete, die wir kennen, Abb. 1 links), und von Molekülen, die als Pharmazeutika eine wichtige Rolle spielen, wie Bortezomib gegen Leukämie (oder Crisaborol gegen Hautkrankheiten, Abb. 1 rechts), ist aber zugleich für viele Menschen ein Exot und vielen aus dem Schulunterricht nur als kleiner oder linker Nachbar vom Kohlenstoff in Erinnerung.
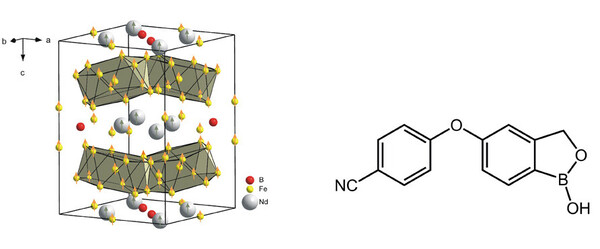
Abb. 1 Links: Nur, wenn nichtmagnetisches Bor zugegen ist, kristallisieren Neodym und Eisen gemeinsam als stark ferromagnetische Verbindung mit besonderer Struktur: Nd2Fe14B; rechts: Crisaborol, ein Phosphodiesterase-4-Hemmer, zurzeit im Zulassungsverfahren gegen entzündliche Hautkrankheiten. (Abbildungen: Arbeitsgruppe B. Albert, TU Darmstadt)
Das mag an seiner Stellung im Periodensystem liegen: Drei Valenzelektronen pro Atom bei vier zur Verfügung stehenden Orbitalen sind zu wenig, um für eine konventionelle Nichtmetallchemie zu stehen. Das vergleichsweise kleine Atom assembliert sich zu komplizierten Kristallstrukturen im Festkörper oder verursacht ungewöhnliche Moleküle mit Elektronenmangel-Bindungen. Die berühmten Wade-Regeln für Mehrzentren-Bindungssysteme helfen, um die Bindung zu verstehen. Boratome finden sich als „Lückenfüller“ von superharten metallischen Werkstoffen, und auch bei wissenschaftlich wie wirtschaftlich ausgesprochen wichtigen Reaktionstypen wie der Hydroborierung und Suzuki-Kopplung sind sie in den Zwischenprodukten präsent.
Charakteristika
Zwischenprodukt oder „Lückenfüller“ ohne besondere Funktion? Bor stabilisiert einzigartige Strukturen und diese sind die Voraussetzung für ungewöhnliche Charakteristika. Der Elektronenmangel, der nichtmetallische, unedle Charakter und die Neigung zur Ausbildung kovalenter Bindungen machen die Relevanz vieler chemischer Substanzen, die Bor enthalten, aus. Die Allotrope von Bor – es gibt mindestens vier gesicherte und höchstens 17 in der Literatur beschriebene – und viele Metallboride sind Refraktärmaterialien, hart und hochschmelzend. Besonders stabil ist Europiumhexaborid, EuB6, bis T > 2700 K (Abb. 2 links).

Abb. 2 Links: Kristalle von EuB6 (Photo: Murat Gürsoy, Martin Bitsch); rechts: Kristallstruktur von EuB6 mit einem Boratom-Netzwerk verknüpfter Oktaeder (rot: Bor-Atome, blau: Europium-Atome). (Arbeitsgruppe B. Albert, TU Darmstadt)
Bis heute streitet man sich darum, welche der Elementmodifikationen die im Grundzustand stabile Form ist. Auch die Anzahl intrinsischer und extrinsischer Defekte in Bor, welche physikalische Eigenschaften wie die elektrische Leitfähigkeit stark beeinflussen, bleibt für die meisten Proben elementaren Bors ein Geheimnis. Deshalb wird es manchmal als Halbleiter und manchmal als Halbmetall beschrieben, ebenso schwanken die Angaben zu seiner Härte und seinem Schmelzpunkt.
Das B-Besondere: es ist das einzige Nichtmetall der 13. Gruppe und (außer Wasserstoff und Helium) das leichteste Nichtmetall, das wir kennen. Mit nur drei Valenzelektronen müssten Bor-Atome eigentlich der sogenannten (8-N)-Regel folgend fünf Bindungen eingehen oder B3+- oder B5--Ionen bilden. Das alles ist ungünstig oder sogar unmöglich – und als Folge sehen wir eine Vielzahl ungewöhnlicher Bindungs- und Koordinationssituationen. Vielfach zeigen die Strukturen wunderschöne, hochsymmetrische Deltaeder wie das Ikosaeder (Abb. 3, links) oder das Oktaeder (Abb. 2, rechts).
Grundlagen und Anwendung
Faszinierende Polyeder, die man eigentlich schon seit Platon kennt, sind also typisch und wohlbekannt für die Chemie borreicher Verbindungen.[1]Neuartig hingegen ist die Dreifachbindung zwischen zwei Boratomen in bei Raumtemperatur stabilen Borinen,[2] von der man lange glaubte, dass es sie nicht geben kann (Abb. 3, rechts).
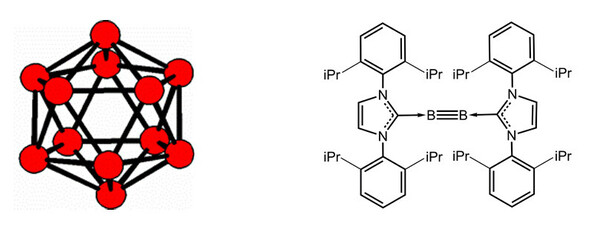
Abb. 3 Links: Ikosaeder aus zwölf Bor-Atomen, eine Baueinheit in α-rhomboedrischem Bor, borreichen Boriden oder auch Dodekahydridododekaboraten [B12H12]2-; rechts: bei Raumtemperatur stabiles, durch sterisch anspruchsvolle Substituenten geschütztes Diborin (Arbeitsgruppe B. Albert, TU Darmstadt).
Schlagzeilen machen Borverbindungen immer wieder. 2001 fand man heraus, dass Magnesiumdiborid, MgB2, supraleitend unter 39 K ist - es handelt sich also um die Substanz, die unter den bis heute bekannten metallischen Supraleitern die höchste Sprungtemperatur aufweist. Breite Anwendung fanden diese Supraleiter noch nicht, auch wenn es Prototypen gibt, die in Magnetresonanztomographie-Magneten funktionieren, also Anwendung in der Medizin finden könnten.[3]
Angewendet wird hingegen die „natürliche" Chemikalie Borsäure, B(OH)3 – und zwar zum Konservieren von Kaviar. Als Mineral heißt sie Sassolit und kommt in großen Mengen in der Türkei und in Kalifornien vor. Heute sind Borsäure, Borate und Perborate, bei denen es sich früher um in großen Mengen für die Industrie (z.B. Waschmittel, Kosmetik, Glas) produzierte, auch kommerziell bedeutsame Produkte handelte, in ihrer Verwendung durch EU-Gesetze stark eingeschränkt. Selbst die Verwendung des Minerals Borax, [Na(H2O)4]2[B4O5(OH)4] ist nicht unumstritten, sowohl für den Einsatz beim Schmieden von Damaszener Stahl (heute eher selten) als auch bei beliebten Mitmach-Experimenten wie „Slime selber machen" (in Kinderlaboren nicht selten). Borax gab Bor seinen Namen: „burä" aus dem Persischen und „buraq" aus dem Arabischen soll „Glänzen" heißen, und der Name kommt von der Verwendung von Borax als Flussmittel.
Andere Borchemikalien wie Bornitrid, BN, oder Borcarbid, B13C2 („B4C“) werden durchaus weiter eingesetzt, beispielsweise als weiche Keramiken und Pigmente in der Kosmetik oder als harte (technische, ballistische) Hochleistungskeramiken. Und Natriumtetrahydridoborat, NaBH4, ist sowohl ein wohlgelittenes Reduktionsmittel in der Chemie als auch – in neuerer Zeit – ein potenzieller Wasserstoffspeicher. Viele andere Einsatzgebiete von Borverbindungen als energierelevante Werkstoffe sind denkbar, zum Beispiel als Hochtemperatur-Thermoelektrika.
Literatur
B. Albert, H. Hillebrecht, Angew. Chem. Int. Ed. 2009, 48, 8640
H. Braunschweig, R. D. Dewhurst, K. Hammond, J. Mies, K. Radacki, A. Vargas, Science 2012, 336, 1420

Prof. Dr. Barbara Albert
Technische Universität Darmstadt Anorganische Chemie
Das Periodensystem ist ein faszinierendes Ordnungssystem, das die Natur den Elementen gegeben hat. Vor 150 Jahren wurde dieses System erstmals von Wissenschaftlern erkannt. Die Generalversammlung der Vereinten Nationen und die UNESCO haben das Jahr 2019 daher zum International Year of the Periodic Table of Chemical Elements, dem Internationalen Jahr des Periodensystems ausgerufen. Die Elemente des Periodensystems werden in loser Folge vorgestellt.

Kommentare
Keine Kommentare gefunden!