Sauerstoff – das Element des Lebens

2019 – Jahr des Periodensystems
Aus unserem Leben ist Sauerstoff nicht wegzudenken. Es gibt kaum Lebewesen auf der Erde, die dauerhaft ohne Sauerstoff auskommen können. Sauerstoff ist an Verbrennungs- und Korrosionsvorgängen beteiligt und stellt gleichzeitig eine der wichtigsten Industriechemikalien dar. Mit Wasserstoff (H2) reagiert Sauerstoff explosionsartig zu Wasser; dies ist die berühmte Knallgasreaktion.
Vorkommen
Es mag überraschen, dass Sauerstoff im Weltall das dritthäufigste Element ist (nach Wasserstoff und Helium); tatsächlich entsteht er in atomarer Form in verhältnismäßig großen Mengen durch Kernfusion im Inneren von Sternen.[1] Auch in gasförmiger Form, bestehend aus zweiatomigen Molekülen O2, ist Sauerstoff in den Atmosphären von Himmelskörpern, wie dem Merkur und einigen Saturn- oder Jupitermonden, und selbst in der Gaswolke um manche Kometen (Komet „Tschuri“, Rosetta-Mission 2015) enthalten. Auf der Erde ist Sauerstoff, in elementarer oder gebundener Form, sogar das häufigste Element und allgegenwärtig. Unsere Luft besteht zu einem Fünftel aus Sauerstoff, die Erdkruste fast zur Hälfte und die Ozeane zu 86 % (Abb. 1). Aufgrund der riesigen Wassermengen in den Ozeanen könnte man meinen, dort wäre der größte Teil des Sauerstoffs auf der Erde gebunden. Tatsächlich ist jedoch die Menge an Sauerstoff, die in den Gesteinen der Erdkruste (z. B. Quarz, Feldspat, Kalk, Silicate, oxidische Erze) steckt, noch tausendmal höher.[2]

Erdgeschichtliche Entstehung des Atmosphären-Sauerstoffs
Zu Beginn der Erdgeschichte gab es nahezu keinen Sauerstoff in der Atmosphäre. Dies änderte sich erst in der Mitte des Präkambriums, als sich im Wasser Vorläufer der heutigen Cyanobakterien massenhaft verbreiteten und unter Ausnutzung des Sonnenlichts Sauerstoff produzierten. Dieser wurde zunächst sofort wieder verbraucht, weil er Reaktionen mit reduzierenden Verbindungen auf der Erdoberfläche einging, zu diesen Verbindungen gehörten beispielsweise solche mit Eisen(II)- und Kupfer(I)-Ionen, Schwefelwasserstoff oder bestimmte organische Substanzen, welche damals noch in großen Mengen vorhanden waren. Erst als der Vorrat an diesen Stoffen zur Neige ging, begann der Sauerstoff vor etwa zwei Milliarden Jahren auch in die Atmosphäre zu entweichen. Für die damaligen Lebewesen, die ja notwendigerweise einen sauerstofffreien (anaeroben) Stoffwechsel hatten, war Sauerstoff giftig; man spricht daher auch von der Großen Sauerstoffkatastrophe (englisch Great Oxygenation Event).[1] Als die Sauerstoffkonzentration der Atmosphäre einige Prozent erreicht hatte, konnte sich eine Ozonschicht bilden, die die Erde vor der ultravioletten Strahlung der Sonne schützte. Wenig später, vor etwa 500 Millionen Jahren, konnte so der Landgang der Pflanzen beginnen, der zu einem weiteren rapiden Anstieg der Sauerstoffkonzentration führte. Nach mehreren Schwankungen bis in das Mesozoikum hinein pendelte sich der Luftsauerstoffgehalt schließlich auf den heutigen Wert ein.
Ist Sauerstoff sauer? – Entdeckung, Eigenschaften und Reaktivität
Die Menschen entdeckten den Sauerstoff erst Ende des 18. Jahrhunderts. Der Schwede Carl Wilhelm Scheele und der Engländer Joseph Priestley waren die ersten, die Sauerstoff als reines Gas herstellten und erkannten, dass es sich um einen bis dahin noch unbekannten Stoff handelte. Es dauerte jedoch noch einige Jahre, bevor der französische Chemiker Antoine Lavoisier die Theorie aufstellte, dass bei der Verbrennung einer Substanz an Luft eine Reaktion mit Sauerstoff erfolgt, denn er konnte durch Wägung nachweisen, dass beispielsweise Metalle im Zuge ihrer Verbrennung schwerer werden. Diese für uns heute so selbstverständliche Interpretation war damals ein fundamentales Forschungsergebnis. Lavoisier beobachtete außerdem, dass Nichtmetalloxide mit Wasser unter Bildung von Säuren reagieren. Er glaubte daher irrtümlich, dass Sauerstoff in allen Säuren enthalten sei und gab ihm 1779 den Namen Oxygenium (griech. „Säurebildner“).[2]
Reiner Sauerstoff ist bei Normalbedingungen ein Gas, welches aus zweiatomigen Molekülen O2 besteht. Dieses Gas ist farblos, geruchlos und natürlich auch geschmacklos. Erst bei sehr tiefen Temperaturen, bei -183 °C (90 K), kondensiert es zu einer blassblauen Flüssigkeit (Abb. 2). Sauerstoff kann jedoch auch in atomarer Form auftreten (als reaktives Zwischenprodukt und im Weltall) sowie in Form des dreiatomigen Moleküls Ozon, O3. Darüber hinaus ist auch ein relativ instabiles Allotrop O4 bekannt.[2] Sauerstoff bildet Verbindungen mit fast allen Elementen und hat von allen bekannten Elementen die zweithöchste Elektronegativität und Elektronenaffinität (nach Fluor). Entgegen dem Eindruck, der durch die Heftigkeit von vielen Reaktionen unter Beteiligung von Sauerstoff (Oxidation) entsteht, ist Sauerstoff bei Raumtemperatur relativ reaktionsträge (kinetisch gehemmt). Viele Oxidationsreaktionen kommen erst nach der Zufuhr von Energie (erhöhte Temperatur, Zündung) in Gang, d.h. es muss erst einmal eine Aktivierungsenergie aufgebracht werden. Es gibt zwar auch Reaktionen mit Sauerstoff, die bereits bei Raumtemperatur stattfinden; diese verlaufen jedoch sehr langsam und mit nur geringer Wärmeentwicklung. Beispiele, die man aus dem Alltag kennt, sind das Rosten von Eisen, das Verspröden von Gummi oder das Ranzigwerden von Ölen.

Die zwei Zustände des Sauerstoffs
Der Grund für die Reaktionsträgheit von Sauerstoff bei Raumtemperatur ist eine Besonderheit seiner elektronischen Struktur: Die beiden energetisch höchstliegenden („äußeren“) Molekülorbitale sind nicht wie bei der Mehrzahl der bekannten stabilen Verbindungen mit zwei Elektronen voll besetzt (Singulett-Zustand), sondern nur mit jeweils einem Elektron. Diese beiden Elektronen haben den gleichen Spin (Eigendrehimpuls), so dass sich das Sauerstoffmolekül im Triplett-Zustand befindet (Abb. 3). Gemäß dem Spin-Erhaltungssatz sind Reaktionen von Triplett-Sauerstoff mit Singulett-Molekülen zu Singulett-Produkten „verboten“ – die meisten organischen Verbindungen haben aber einen Singulett-Grundzustand und denkbare Oxidationsprodukte ebenfalls. Die Reaktionen solcher Verbindungen mit Triplett-Sauerstoff sind folglich durch hohe Aktivierungsbarrieren charakterisiert und verlaufen sehr langsam, wenn sie nicht durch Energiezufuhr oder durch Zugabe von Aktivatoren (Initiatoren, Katalysatoren) in Gang gebracht werden. Letztendlich ist es die Spinerhaltung, die das Leben auf der Erde bewahrt, denn vom energetischen (thermodynamischen) Standpunkt her müsste jedwede organische Materie in Kontakt mit Sauerstoff zu Kohlendioxid und Wasser umgesetzt werden (verbrennen). Andererseits sind lebende Organismen genau auf diese Verbrennungsreaktion angewiesen: Um die Energie zu erzeugen, die sie zum Leben brauchen, nutzen sie die kontrollierte Oxidation von organischen Verbindungen mit Sauerstoff, welche in komplexen Reaktionsketten mit geeigneten Katalysatoren, den Enzymen, gelingt (kalte Verbrennung). Die Aufnahme des Sauerstoffs erfolgt bei Wirbeltieren in der Lunge an den Eisenionen des Hämoglobins, das ihn ins Innere der Muskelzellen transportiert, wo er zur Verwendung bei der Atmung durch Myoglobin (ein sehr ähnliches Eisenprotein) gespeichert wird. In der Biochemie des Menschen wird Sauerstoff jedoch nicht nur zur Energieerzeugung durch Verbrennung, sondern auch zur Synthese von nützlichen Substanzen bzw. zum Abbau von Schadstoffen eingesetzt. Hierzu muss Sauerstoff ebenfalls zunächst an Metallionen in den aktiven Zentren von Enzymen gebunden werden, die ihn dann für Folgereaktionen aktivieren.

Auch Licht kann Sauerstoff für chemische Reaktionen aktivieren, indem es ihn vom Triplett- in den Singulett-Zustand überführt, denn aus dem Singulett-Zustand heraus ist die Oxidation von organischen Verbindungen leicht möglich. Dieser Zustandswechsel mit Licht ist jedoch wegen der nötigen Spinumkehr nach den Auswahlregeln für optische Übergänge ebenfalls verboten (die Absorption von sichtbarem oder ultraviolettem Licht durch molekularen Sauerstoff ist somit sehr gering) und kann daher nur in der Anwesenheit von Hilfsmolekülen stattfinden. Solche Hilfsmoleküle können Farbstoffe (Pigmente) sein, die das Licht absorbieren und diese Energie dann an den Sauerstoff weitergeben. Der dabei gebildete Singulett-Sauerstoff kann anschließend unter Energieabgabe wieder in den Grundzustand zurückkehren oder vor Ort das Pigment oxidieren, und so erklärt sich das Ausbleichen von Farben oder das Vergilben von Kunststoffen im Licht. Auch in Pflanzen kann das Zusammenwirken von Sonnenlicht mit Pigmenten, wie dem Chlorophyll, reaktiven Singulett-Sauerstoff in für die Zellen zerstörerischen Mengen erzeugen. Die Zellen von Pflanzen enthalten daher auch effiziente Desaktivatoren, wie beispielsweise β-Carotin.[4]
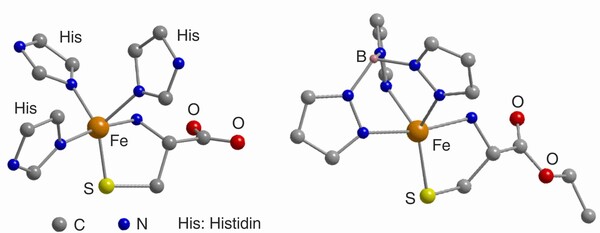
Verwendung von Sauerstoff in katalytischen Prozessen
Etwa 20 % aller Prozesse in der Wertschöpfungskette der chemischen Industrie basieren auf Oxidationsreaktionen.[5] Beispielsweise erfordert die Nutzung einfacher Kohlenwasserstoffe zur Synthese von Feinchemikalien und Funktionsmaterialien in der Regel einen Oxidationsschritt, und die Verwendung des preiswerten, gut verfügbaren und umweltfreundlichen Sauerstoffs hierzu ist natürlich wünschenswert. Aus den oben geschilderten Gründen müssen Oxidationsreaktionen mit O2 jedoch zumeist durch einen Metallkatalysator vermittelt werden, der idealerweise auch für die entsprechende Selektivität sorgt. Die Entwicklung von neuen Oxidationskatalysatoren und die Untersuchung ihrer Wirkungsmechanismen [6] stellen daher wichtige, intensiv bearbeitete Forschungsgebiete dar. In industriellen Verfahren kommen als Katalysatoren oftmals Metalloxide zum Einsatz, die bei vergleichsweise hohen Temperaturen arbeiten. Umso bemerkenswerter ist es, dass in der Natur Metalloenzyme industriell interessante Oxidationsreaktionen unter sehr milden, physiologischen Bedingungen bewerkstelligen können. Aktuelle Katalyseforschung nutzt mitunter solche sauerstoffaktivierenden Enzyme, Oxygenasen und Oxidasen, als Inspiration zur Entwicklung von synthetischen, niedermolekularen Analoga (Abb. 4), deren Potential zur O2-Aktivierung dann untersucht wird.[7]
M. H. Thiemens, Nature Chemistry 2012, 4, 66.
H. Sitzmann, J. Hartmann-Schreyer: Sauerstoff. In: ROEMPP online, Georg Thieme Verlag KG. URL: roempp.thieme.de/roempp4.0/do/data/RD-19-00520 (Stand März 2016).
David R. Lide (ed.): CRC Handbook of Chemistry and Physics, 85. Auflage, CRC Press, Boca Raton, Florida, 2005.
F. Ramel, S. Birtic, S. Cuine, C. Triantaphylide, J.-L. Ravanat, M. Havaux, Plant Physiol. 2012, 158, 1267-1278.
U. Bornscheuer, R. W. Fischer, L. J. Gooßen, R. Schlögl, R. Schomäcker, S. Schunk, Positionspapier Katalytische Oxidationsreaktionen als Schlüsseltechnologie, Dechema 2015, Hrsg. Deutsche Gesellschaft für Katalyse.
C. Limberg, Angew. Chem. 2003, 115, 6112-6136.
M. Sallmann, C. Limberg, Acc. Chem. Res. 2015, 48, 2734-2743.

Prof. Dr. Christian Limberg
Institut für Chemie, Humboldt-Universität zu Berlin

Dr. Christian Herwig
Institut für Chemie, Humboldt-Universität zu Berlin
Das Periodensystem ist ein faszinierendes Ordnungssystem, das die Natur den Elementen gegeben hat. Vor 150 Jahren wurde dieses System erstmals von Wissenschaftlern erkannt. Die Generalversammlung der Vereinten Nationen und die UNESCO haben das Jahr 2019 daher zum International Year of the Periodic Table of Chemical Elements, dem Internationalen Jahr des Periodensystems ausgerufen. Die Elemente des Periodensystems werden in loser Folge vorgestellt.
Titelbild: Peter Schreiber/stock.adobe.com

Kommentare
Keine Kommentare gefunden!