Zinn – von Mysterien zu Ungewöhnlichem
2019 - Jahr des Periodensystems
Das Element Zinn ist uns seit Jahrtausenden allgegenwärtig und steht bis heute im Mittelpunkt des Interesses, ob mit kuriosen Geschichten wie über die Zinnpest bei Zinnknöpfen, die zum Niedergang von Napoleons Armee im Russland-Feldzug geführt haben sollen, oder aber mit ungewöhnlichen chemischen Eigenschaften. So kommt die supraleitende Legierung Nb3Sn in Elektromagneten zum Einsatz, und in Kombination mit Indium bildet es das transparente Oxid „ITO“ (= Indium Tin Oxide), das metallische Eigenschaften besitzt und für den Bau von Leuchtdioden, Touchscreens und Solarzellen unerlässlich ist. Molekulare Zinnverbindungen verringern in Autoreifen den Reibungswiderstand und das Element bildet nicht nur die für Metalle typischen Kationen, sondern auch sehr ungewöhnliche Anionen.
Mit der Ordnungszahl 50 steht Zinn fast in der Mitte des Periodensystems. Seine Stellung an der Grenze von Metallen zu Nichtmetallen mit dem Vorgänger Indium und Nachfolger Antimon, welche eindeutig Metall bzw. Nichtmetall sind, zeigt Zinn in seiner normalen Modifikation noch metallische Eigenschaften, doch besitzt es mit dem nur sehr kleinen energetischen Unterschied von 2 kJ/mol auch eine typische Nichtmetall-Struktur, bei der es seine metallischen Eigenschaften verliert.
Zinn als Gebrauchsmetall
Als Gebrauchsmetall ist das Element Zinn seit Jahrtausenden allgegenwärtig. Bis ca. 3000 v.Chr. war es als Legierungsbestandteil z.B. mit Kupfer in Bronze bekannt, doch gibt es auch Funde, die belegen, dass Zinn bereits ca. 1200 v.Chr. in reiner Form bekannt war.[1] Bei Homer ist der Begriff der „zinnernen Beinschienen“ beschrieben, und Hippokrates nennt es das „gesündeste der Metalle“.[2] Das Metall kann wegen seines tiefen Schmelzpunkts leicht gegossen werden, und zur Zeit der Römer gab es bereits den Beruf des Zinngießers (stagnator oder stannator). Ess- und Trinkgefäße aus Zinn waren über Jahrhunderte beliebt und erwiesen sich z.B. gegenüber Wein in Vergleich zu Eisen, Kupfer oder Bronze als weniger oxidationsempfindlich, was dazu führte, dass auf dem Konzil von Reims 813 verabschiedet wurde, dass Priester in Gemeinden mit Geldmangel statt Gold- und Silberkelchen billigere Zinngefäße nutzen durften.
Große mediale Aufmerksamkeit erlangte das Element Zinn 1784. Zu dieser Zeit war Zinn umfassend als Geschirr im Haushalt und bei den Armeen im Einsatz, und es machte das Gerücht die Runde, dass Zinn wegen des Arsengehalts aus dem Alltag zu verbannen sei. Grundlage war eine wissenschaftliche Abhandlung Mitte des 18. Jahrhunderts von Henkel und Marggraf, die beschrieb, dass Zinn große Mengen Arsen enthielte. [3] Aber erst nach dessen Übersetzung ins Französische schlug der Bericht Wellen, so dass das französische Kriegsheer beim königlichen französischen Staabs- und Ober-Feldapotheker Bayen eine Studie in Auftrag gab (Abb. 1). In der Übersetzung liest man: „so lange als die Versuche dieser beyden Chymisten in Frankreich, blos den kleinen Theil von Einwohnern bekannt wurden, die daselbst die Chymie studiren, so machte sie bey uns (Frankreich) eben so wenig Eindruck als in Deutschland. Da aber die Schriften des Herrn Marggrafs übersetzt und so herausgegeben wurden, daß sie einer größern Anzahl von Lesern unter die Hände kamen, so hatten sie auf einige eine ganz andre Wirkung. Man hörte sogleich vom Zinn und von dem Arsenik, den es enthielte, sprechen, und mancher der die Marggrafischen Schriften nie gelesen hatte, führte sie an und behauptete immer, man müsse ein Metall, das durch eine so furchtbare Substanz verdorben wäre gänzlich verbannen.“[4] Schlussendlich ergaben die Untersuchungen, dass die Gefahr bei handelsüblichem Zinn eher von durch die Zinngießer illegal zugesetztes Blei als dem Arsen zuzuschreiben war: „…und daß im Gegentheil aller der Schade, den zinnerne Gefäße verursachen können, einzig und allein von dem gesetzwidrigen Verfahren der Zinngießer herrühre, welche das zu verarbeitende Zinn mit zu häufigem Bleye versetzen.“[4] Diese Unsitte war bereits nach dem 30-Jährigen Krieg (1618 – 1648) eingeführt worden, als Zinn in Folge der Materialknappheit sehr stark mit Blei legiert wurde, so dass die Gegenstände sehr dunkel und schwer waren.

Neben den wissenschaftlichen Inhalten ist diese Schrift als ein früher Beleg zu sehen, wie jeher durch unkritische Übernahmen von auszugsweisen Inhalten durch Nicht-Chemiker Tatsachen geschaffen werden, die irreführend sind und sogar zu sinnlosen wirtschaftlichen Veränderungen führen können.
Ein Metall mit“ kovalentem Charakter“ - Geschichten zur Zinnpest
Ca. 150 Jahre später stand Zinn wieder im medialen Mittelpunkt, und bis heute wird die Frage, ob die Zinnpest den Soldaten Napoleons beim Russlandfeldzug 1812 zum Verhängnis wurde, da die Zinnknöpfe ihrer Uniformen in der russischen Kälte zerbröselten und die Soldaten erfroren, kontrovers diskutiert. Tatsache ist, dass Zinn bei Temperaturen unter 13.2°C einer allotropen Umwandlung unterliegt, die allerdings kinetisch enorm gehemmt ist und deshalb sehr langsam erfolgt. Kristallisationskeime dieser sogenannten alpha-Modifikation bewirken eine Herabsetzung der kinetischen Hemmung, was den Begriff „Zinnpest“ prägte.[5,8] Die Umwandlung bei Temperaturerhöhung erfolgt spontan.
Aus heutiger Sicht ist diese Phasenumwandlung immer noch faszinierend, denn sie zeigt, wie nahe metallische und kovalente Bindung energetisch beieinanderliegen können. Bereits unter Standardbedingungen weicht das Metall Zinn in seiner tetragonalen Form deutlich von den dichtesten Kugelpackungsmodellen, die bei Metallen sehr häufig sind, ab. Und nur knapp unterhalb den Standardbedingungen erfolgt die Umwandlung des metallischen ß-Zinns (weißes Zinn) in die alpha-Modifikation (graues Zinn), in der die Atome wie beim Element Kohlenstoff die Diamantstruktur mit tetravalenten Atomen ausbilden (Abb. 2). Analog dem Wasser tritt das Paradoxon auf, dass die Tieftemperaturform weniger dicht ist als die Hochtemperaturform. Den kovalenten Charakter der Bindungen zwischen den Zinnatomen in der Tieftemperaturmodifikation kann man direkt an der Versprödung des sonst duktilen Zinns erkennen, welche zusammen mit der Volumenzunahme beulenartige Veränderungen auf der Oberfläche bewirkt (Abb. 3a und 3b).[6]
Vorkommen, Entdeckung und Strukturen



Wie beim oben beschriebenen Arsengehalt gab es bis zur wissenschaftlichen Klärung des Phasenübergangs ins Mystische reichende Berichte zum Zerfall von Orgelpfeifen, Münzen, Knöpfen und Zinnbarren (Abb. 4). Obwohl diese Berichte in der Publikation von E. Cohen und C. van Eijk grundlegend aufgearbeitet wurden, [5] werden die Geschichten bis heute weitergetragen. So darf man den Berichten, in denen kältebedingte Verwerfungen auf Münzen oder dem Zerfall von im Zollhaus von St. Petersburg gelagerten Blöcken von Banka-Zinn – dem früher überwiegend verwendeten Handelszinns – Glauben schenken, doch findet man keine belastbaren Belege zu der Geschichte der kältebedingten Zerbröselung der Uniformknöpfe der Soldaten Napoleons während des Russlandfeldzugs 1812, welche zu deren Niederlage geführt haben soll. Hier handelt es sich lediglich um eine Annahme, die in einem unterhaltsamen Buch über „Moleküle“ gemacht aber nicht belegt wurde.[7] Wie diese Geschichte erweisen sich auch andere, insbesondere im Internet verbreiteten Berichte zur Zinnpest bei genauer Betrachtung als Mär. Allerdings waren in einem Militärlager auch Knöpfe gelagert worden, die ebenfalls zerfallen sein sollen. Bei Orgelpfeifen mag man dem Bericht von L. Erdmann von 1851 Glauben schenken, im Allgemeinen [8] und auch in der Wiener Kapuzinergruft (Abb. 3c) sind jedoch häufiger Korrosion, welche ebenfalls zu Verwerfungen der Zinnoberfläche führt, die Schadensursache. In vielen Fällen wurde nicht reines Zinn verarbeitet, sondern eine bleihaltige Zinn-Legierung, welche die kinetische Hemmung zur Phasenumwandlung zudem erhöht oder die Phasenumwandlung vollständig unterdrückt. Zusätze von Arsen, Blei, Antimon oder Bismut hemmen, Zink sowie Aluminium erleichtern hingegen die Phasenumwandlung.

Im Vergleich zur Zinnpest sind deutlich weniger Berichte verfügbar, in denen die elektrischen und elektronischen Eigenschaften der Tieftemperaturmodifikation des Zinns belegt sind. Durch die Versprödung der Zinn-Einkristalle lässt sich daran keine Messung der elektrischen Leitfähigkeit durchführen, und beim Verpressen der spröden Pulver bildet sich wieder die ß-Form aus. Der einzige dem Autor zweifelsfrei bekannte Nachweis erfolgte durch Hochfrequenzverlust-Messungen, bei welchen die Analogie des temperaturabhängigen Verhaltens des Zinns zu den halbleitenden Elementen Silicium und Germanium hergestellt werden konnte.[9]
Polyanionen des Zinns – 85 Jahre bis zur strukturellen Aufklärung des „Nonastannids“
Die Klärung der eigentümlichen Eigenschaft des Elements Zinn, neben Kationen entgegen den Eigenschaften der meisten Metalle auch Anionen zu bilden, erwies sich als sehr langwierig. Von der Beobachtung, dass in flüssigem Ammoniak gelöstes Natrium mit Metallen tieffarbene Lösungen ausbildet,[10] bis zum ersten strukturellen Nachweis des Polyanions [Sn9]4-,[11] vergingen 85(!) Jahre. Dazwischen brachten Eduard Zintls genaue analytische Verfahren Hinweise auf das Vorliegen von Polyanionen, deren Bindungscharakter die herkömmlichen Atombindungsmodelle sprengte. Die bindungstheoretische Beschreibung gelingt, wenn man die Regeln, die für die Beschreibung der Elektronenmangelverbindungen der polyedrischen Borwasserstoffmoleküle herangezogen werden, erweitert. Bis heute steht die faszinierende Chemie der Polyanionen des Zinns im Mittelpunkt des Interesses (Abb. 5a). Die Liganden-freien Cluster stellen eine quasi aktivierte, lösliche und sehr reaktive Elementform dar, die eine Vielzahl von Reaktionen ermöglicht und einen Zugang zu sogenannten „intermetalloiden Clustern“ eröffnet.[12] Durch Disproportionierungsreaktionen ist der Aufbau von Atomclustern möglich, die z.B. aus bis zu 15 Zinnatomen und vier Titanatomen aufgebaut sind, wobei die Titanatome entweder an Liganden gebunden sein können, oder auch wie in intermetallischen Verbindungen Liganden-frei an Zinnatome gebunden sind (Abb. 5c).[13]
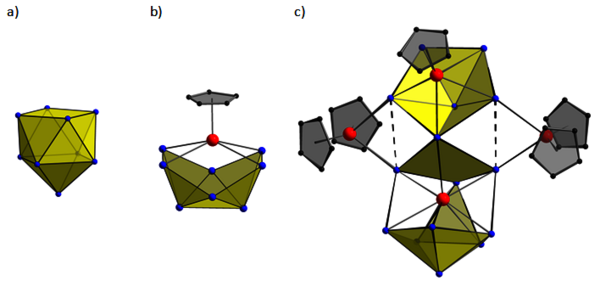
Abb. 5. Atomare Strukturen von Zinn-Polyanionen. a) [Sn9]4-, [11], b) [(CpTi)(Sn8)]3-, c) (Cp2Ti)2(CpTi)Ti(Sn15)]4-. [13] (Cp = C5H5), Sn-, C- und Ti-Atome sind blau, schwarz bzw. rot dargestellt. (Thomas Fässler, TU München)
Literatur
[1]Bronze Age tin rings from the Tollense valley, J. Krüger, F. Nagel, S. Nagel, D. Jantzen, R. Lampe, J. Dräger, G. Lidke, O. Mecking, T. Schüler. T. Terberger, Prähistorische Zeitschrift, 2012, 87, 19-43.
[2]Bronze – Beitrag zur Technikgeschichte , Wissenschaftlicher Aufsatz, 2010, 36 Seiten, Ingenieurwissenschaften - Metallbautechnik / Metallverarbeitung, W. Piersig.
[3] A. S. Marggraf, Hist. Acad. Sci. Berlin 1747, 33.
[4] Herrn Bayen, Königl. französischen Staabs- und Ober-Feldapothekes chymische Untersuchungen über das Zinn, und Beantwortung der Frage: Ob man sich ohne Gefahr zu ökonomischen Gebrauche der zinnernen Gefäße bedienen könne? Auf Befehl der Französischen Regierung, übersetzt von D. Johann Gottfreid Leonhardi, Siegfried Lebrecht Crusius, Leipzig, 1784, S. 161 (http://vd18.de/de-bsb-vd18/content/titleinfo/26019008).
Anmerkung: In derselben Schrift wird auch das Zinnblech (Weißblech) untersucht. Der Begriff des Lokalelements war noch nicht geboren, doch die damit verknüpften Probleme von Zinn-überzogenen Eisenflaschen schon wohlbekannt: „Man darf also nicht hoffen, daß man Wein oder irgend eine andere sauerliche Flüssigkeit in blechernen Flaschen aufbehalten könnte, in weniger als vier und zwanzig Stunden, würde der Wein eine Zerlegung anfangen, und einen dintenhaften Geschmack bekommen, der wie bekannt sehr unangenehm ist.“, ibid. S. 212.
[5] Ueber die Einwirkung strenger Kälte auf Blockzinn. J. Fritzsche, Polytechnisches Journal, 1869, Band 191/Miszelle 3, 171. Der Begriff Zinnpest findet sich erstmals in: Physikalisch-Chemische Studien am Zinn, E. Cohen, C. van Eijk, Z. Physik. Chem. 1899, 30, 601-622.
[6] Das Phänomen wurde in der wissenschaftlichen Literatur erstmalig erwähnt in [5] sowie Ueber eigenthümlich modificirtes Zinn, J. Fritzsche, Ber. dt. chem. Gesellschaft, 1869, 2, S 112 (DOI: 10.1002/cber.18690020156).
[7] Napoleon's Buttons, How 17 Molecules Changed History, P. Le Couteur, J. Burreson, J. P. Tarcher/Penguin, 2004.
[8] „Zinnpest ist als Begriff schon alt und wurde gerne verwendet, um unliebsame Orgeln leichter aufgeben zu können. (..) In der Praxis findet dieser Vorgang jedoch, zumindest im Orgelbau, nur extrem selten statt.“ aus Mitteilungen aus dem LVR-Amt für Denkmalpflege im Rheinland, Heft 21, 2014. Durch das dem Zinn zugesetzte Blei entsteht durch Kontakt mit Eichenholz und dem eingesetzten Weißleim Bleikorrosion.
[9] Elektrische Eigenschaften des grauen Zinns. B. Busch, J. Wieland, H. Zoller, Helv. Phys. Acta 24, 1951, 49-62.
[10] Action du sodammonium et du potassammonium sur quelques méteaux. M. Joannis, Hebd. Seances Acad. Sci. 1891, 113, 795.
[11] Zintl’s “Polyanionige Salze”: Darstellung und Eigenschaften der kristallinen Verbindungen [Na4 7en]Sn9, [Na4 5en]Ge9, [Na3 4en]Sb7 und ihrer Lösungen. Die Kristallstruktur von [Na4 7en]Sn9. L. Diehl, K. Khodadadeh, D. Kummer, J. Strähle, Chem. Ber. 1976, 109, 3404.
[12] Homoatomic Zintl Ions, Cage Compounds, and Intermetalloid Clusters of Group 14 and Group 15 Elements. S. Scharfe, F. Kraus, S. Stegmaier, A. Schier, T. F. Fässler, Angew. Chem. Int. Ed. 2011, 50, 3630.
[13] On the formation of intermetalloid clusters: Titanocen(III)diammin as a versatile reactant towards nonastannide Zintl Clusters. C. B. Benda, M. Waibel, T. F. Fässler, Angew. Chem. Int. Ed. 2015, 54, 522.
[14] E. Cohen, Zeitschrift für physikalische Chemie, Band, 1911, 17, 181.

Prof. Dr. Thomas Fässler
Lehrstuhl für Anorganische Chemie mit Schwerpunkt Neue Materialien, Department Chemie, Technische Universität München
Das Periodensystem ist ein faszinierendes Ordnungssystem, das die Natur den Elementen gegeben hat. Vor 150 Jahren wurde dieses System erstmals von Wissenschaftlern erkannt. Die Generalversammlung der Vereinten Nationen und die UNESCO haben das Jahr 2019 daher zum International Year of the Periodic Table of Chemical Elements, dem Internationalen Jahr des Periodensystems ausgerufen. Die Elemente des Periodensystems werden in loser Folge vorgestellt.


Kommentare
Keine Kommentare gefunden!