Wißmad Ärcz, Bisemutum, Wismut, Bismut
2019 – Jahr des Periodensystems
Elementares Bismut wurde nach heutigem Kenntnisstand im 14. Jahrhundert bei Schneeberg im Sächsischen Erzgebirge entdeckt. Vermutlich ging die Nutzung des Elements, welches aus dem als Wismutocker oder Wismutblüte bekannten oxidischen Erz erschmolzen wurde, insbesondere als Pigment für silbern glänzende Schriften (scriptura argentea) und Miniaturmalereien der Entdeckung von gediegenem Wismut in Bergwerken voraus. Bereits Mitte des 15. Jahrhunderts gewann Bismut Bedeutung als Legierungsbestandteil von Drucklettern. Durch den Zusatz von Bismut lässt sich zum einen der Schmelzpunkt absenken, zum anderen werden die Drucklettern härter und nutzen sich langsamer ab. Die Dichteanomalie des Bismuts, das sich beim Erstarren um etwa 3,3 % ausdehnt, sorgt außerdem für eine detailgenaue Abbildung der Gussform. Die wohl früheste Erwähnung des Elements in einem gedruckten Werk findet sich bei Ulrich Rülein von Calw, einem Universalgelehrten, der in Sachsen wirkte und in seinem 1505 anonym erschienenen "Ein wolgeordnetz unnd nuczlicho büchlin wie man bergwerck suchen und erfinden sol ..." das "wißmad ärcz" aufführt. Georg Agricola geht in seinen Werken "Bermannus sive de re metallica" von 1530 und "De natura fossilium" von 1546 auf das von ihm latinisierte "bisemutum" ein und grenzt es von Blei, Zinn und anderen Mineralien ab. Die Herkunft des Namens ist nicht eindeutig geklärt. Naheliegend ist die Ableitung aus dem mittelhochdeutschen "wîz" für weiß und "masse" für Masse, Klumpen oder Erzklumpen. Vermutlich wurde damit zunächst der gelblich-weiße Wismutocker bezeichnet, später dann auch das Element. Heute ist der verbindlich festgelegte Name des Elements Bismut (engl. bismuth; Elementsymbol Bi), während das Erz im deutschen Sprachgebrauch weiterhin als Wismut bezeichnet wird.
Mit einem geschätzten Massenanteil von rund 2•10–5 % steht Bismut an 65. Stelle der Elementhäufigkeit in der Erdhülle. Gediegenes Bismut kommt in der Natur vor, ist aber sehr rar. Die häufigsten bismuthaltigen Erze sind Bismutin (Wismutglanz, Bi2S3), Bismit (Wismutocker, α-Bi2O3) und Bismutit (Bi2O2CO3). Sie werden hauptsächlich in China, Vietnam und Mexiko abgebaut; die Weltbergwerksproduktion betrug im Jahr 2015 ca. 13.300 Tonnen. Oxidische Erze werden mit Kohle im Herdofen reduziert; sulfidische Erze werden zunächst geröstet oder direkt mit unedlen Metallen reduziert. Die Aufreinigung erfolgt durch oxidierendes Schmelzen unter Zusatz von Alkalien oder durch elektrolytische Raffination (Abbildung 1). Erhebliche Mengen elementaren Bismuts fallen als Nebenprodukt bei der Blei- und Kupfergewinnung an (ca. 10.000 Tonnen pro Jahr).

Natürliches Bismut besteht nur aus dem Isotop 209Bi. Dass dieses ein Alpha-Strahler mit einer Halbwertszeit von etwa 1,9•1019Jahren ist, bleibt für den praktischen Umgang bedeutungslos. Reines Bismut ist ein silberglänzendes Halbmetall, das unter allen festen Metallen den am meisten ausgeprägten Diamagnetismus, den stärksten Hall-Effekt und die geringste thermische Leitfähigkeit aufweist. Für kompakte Bismutproben sind keine Gefahrenhinweise (H- und P-Sätze) ausgewiesen, wohingegen das Pulver als entzündbarer Feststoff gilt. Bismut wird keine biologische Funktion zugeschrieben; es hat jedoch antiseptische Eigenschaften. So kommen seit Langem bismuthaltige Präparate zum Einsatz, u. a. als Brandsalben, zur Behandlung von Hautentzündungen und Hämorrhoiden sowie zur Therapie von Darminfektionen und Magengeschwüren.
Als Mitglied der Gruppe 15 (V. Hauptgruppe) des Periodensystems gehört Bismut zu den elektronenreichen Elementen. Nach der Oktettregel wird prinzipiell die Ausbildung von drei kovalenten Bindungen erwartet. Hierfür werden fast ausschließlich die 6p-Orbitale genutzt, so dass die Bindungswinkel in der Regel nahe 90° liegen. Da bei den schweren Elementen der 6. Periode die Valenzorbitale vergleichsweise ausladend sind und daher eine relativ geringe Elektronendichte aufweisen, stellen Mehrzentrenbindungen energetisch konkurrenzfähige Alternativen zu klassischen Zweizentrenbindungen dar. So finden sich häufig mehr als drei Bindungspartner am Bismutatom, oft in Anordnungen, die sich vom Oktaeder ableiten. Dem zugrunde liegen (nahezu) lineare, fast immer asymmetrische Dreizentrenbindungen, die wie die p-Orbitale am zentralen Bismutatom zueinander senkrecht stehen. Die Bedeutung des energetisch tiefliegenden 6s2-Elektronenpaars für die gewöhnlich anzutreffenden Verzerrungen in den Koordinationsumgebungen von Bismutatomen ist umstritten.
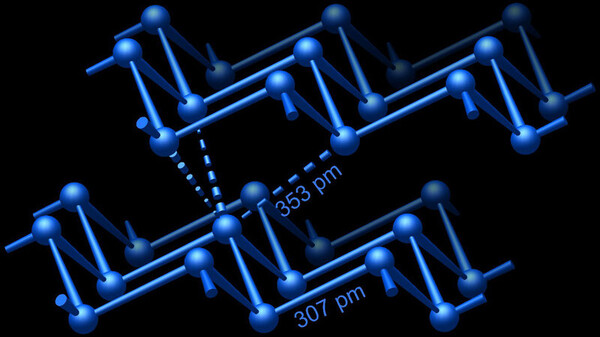
Die beschriebene Bindungstypologie zeigt sich u. a. in den Allotropen des Bismuts: Die rhomboedrische Standardmodifikation des Bismuts ist, isotyp zu Antimon und grauem Arsen, aus gewellten Schichten aufgebaut (Abbildung 2). Innerhalb der Schichten sind die Bismutatome dreibindig verknüpft; drei nur 15 % weiter entfernte Atome der Nachbarschicht vervollständigen die verzerrt oktaedrische Umgebung. Die weitgehende Lokalisierung der Valenzelektronen hat zur Folge, dass Bismut unter Normalbedingungen ein schlechter elektrischer Leiter (Halbmetall) ist. Hingegen sind die Strukturen der zahlreichen Hochdruckphasen des Bismuts durch hohe Koordinationszahlen geprägt, und die zugehörigen (nicht nur orthogonalen) Mehrzentrenbindungen sind zu durchgängigen Bindungssystemen verknüpft. Hieraus resultieren metallische Leiter, die sogar bei Temperaturen von wenigen Kelvin in den supraleitenden Zustand übergehen können.
In den meisten seiner Verbindungen liegt Bismut in der Oxidationsstufe +III vor; die wenigen bekannten Bismut(V)-Salze beschränken sich auf Oxide und Fluoride. Es gibt darüber hinaus eine vielfältige Chemie des Bismuts in niediger positiver Oxidationsstufe, wobei Bismutatome über Zwei- oder Mehrzentrenbindungen verknüpft sind. Dies führt von (organometallischen) Molekülen über homoatomare Polykationen und heteroatomare Cluster bis hin zu ausgedehnten Bismutteilstrukturen in Subhalogeniden oder intermetallischen Phasen. In Kombination mit Metallen geringer Elektronegativität bilden sich Bismutpolyanionen und Bismutide(–III).
Bismut fand bisher vor allem Verwendung in niedrigschmelzenden Legierungen, wie zum Beispiel dem Woodschen Metall (Schmelzpunkt 70 °C). Solche Legierungen werden u. a. eingesetzt als Schmelzsicherungen, in automatischen Brandmeldern und Sprinkleranlagen, als Wärmebad, Gußformen für Polymere und als Masse für den Abguss von Objekten, die nicht durch hohe Temperaturen geschädigt werden dürfen. Inzwischen werden anorganische Bismutverbindungen zunehmend als Ersatz für bleibasierte Pigmente und Funktionsmaterialien genutzt, was zu einer erhöhten Nachfrage auf dem Weltmarkt führt. Daneben gibt es noch eine Reihe von Spezialanwendungen, u. a. Bismutelektroden zur pH-Messung, Bismutmolybdat als Katalysator im Sohio-Prozess oder Bismuttellurid in thermoelektrischen Energiewandlern. Eine ganze Reihe von komplexen Oxobismutaten zählt unter die Hochtemperatursupraleiter. Eine Entdeckung aus jüngster Zeit sind topologische Isolatoren, unter denen sich viele halbleitende, bismutreiche Verbindungen finden. Hierbei ist die starke Spin-Bahn-Kopplung der Valenzelektronen der Bismutatome essentiell für einen auch bei Raumtemperatur nutzbaren Quanteneffekt, der für die Spintronik und die Entwicklung von Quantencomputern wichtig werden dürfte.

Prof. Dr. Michael Ruck
Fachrichtung Chemie und Lebensmittelchemie Technische Universität Dresden
Das Periodensystem ist ein faszinierendes Ordnungssystem, das die Natur den Elementen gegeben hat. Vor 150 Jahren wurde dieses System erstmals von Wissenschaftlern erkannt. Die Generalversammlung der Vereinten Nationen und die UNESCO haben das Jahr 2019 daher zum International Year of the Periodic Table of Chemical Elements, dem Internationalen Jahr des Periodensystems ausgerufen. Die Elemente des Periodensystems werden in loser Folge vorgestellt.


Kommentare
Keine Kommentare gefunden!