Von Pancromium über Eritronium zum Vanadium

2019 – Jahr des Periodensystems
Historisch betrachtet hat das Element Vanadium bereits einiges hinter sich, mehrere Entdeckungen und Namensänderungen eingeschlossen. Erstmals als Element identifiziert, wurde das Vanadium durch den spanisch-mexikanischen Chemiker und Metallurgen Andrés Manuel del Rio.[1] Del Rio, ein ehemaliger Student Lavoisiers, der auch in Freiberg und Chemnitz studierte, entdeckte das farbenfrohe Element 1801 in verschiedenen Mineralproben aus einer mexikanischen Mine. Beeindruckt durch die Farbvielfalt der erhaltenen Verbindungen nannte er das metallische Element Pancromium (griech. pan: ganz, alle, chroma: Farbe). Als del Rio feststellte, dass sich viele der Verbindungen nach Hitzeeinwirkung rot verfärbten (Bildung von V2O5), änderte er den Namen des Elementes in Eritronium (griech. erythros: rot). Zur Verifikation des neuen Elementes übergab del Rio einige Proben an seinen Bekannten, Alexander von Humboldt, der die Proben an einen französischen Chemiker weiterleitete. Dieser erkannte in den Proben fälschlicherweise nur verunreinigte Chrom-Verbindungen, woraufhin von Humboldt die Neuentdeckung bestritt und del Rio seine Entdeckung als vermeintlichen Fehler zurückzog.[2]
29 Jahre später, im Jahr 1830 berichtete der schwedische Forscher Nils Sefström, ein Schüler von Berzelius, über die Entdeckung eines neuen Elements, welches er Vanadium taufte. Der Name geht zurück auf Vanadis, die nordische Göttin der Schönheit und Fruchtbarkeit (häufiger bekannt als Freya). Die Namenswahl geht neben den offensichtlichen Farbassoziationen (Abb. 1) auch auf den profanen Grund zurück, dass zu diesem Zeitpunkt noch kein Element mit dem Anfangsbuchstaben (und damit dem Elementsymbol) „V“ bekannt war. Kurz nach dieser Wiederentdeckung zeigte Friedrich Wöhler, dass die Elemente Vanadium und Eritronium identisch sind. Der nachfolgende Vorschlag, Vanadium zu Ehren des ursprünglichen Entdeckers in Rionium umzubenennen, wurde dagegen nie umgesetzt.
Sefström entdeckte das Vanadium übrigens als Bestandteil in Eisenlegierungen, ein erster Hinweis auf den Einsatz von Vanadium zur Herstellung von widerstandsfähigen Vanadium-Stählen. Der erste großtechnische Einsatz dieser Stahllegierung fand übrigens in den Chassis des Ford Model T statt.

Abb. 1: Vanadium in all seiner Farbigkeit: v.l.n.r.: [VII(H2O)6]2+, [VIII(H2O)6]3+, [VIVO(H2O)5]2+ und [VVO(H2O)5]3+. (Steffen Kristensen (https://commons.wikimedia.org/wiki/File:Vanadiumoxidationstates.jpg), „Vanadiumoxidationstates“, als gemeinfrei gekennzeichnet)
2. Vanadium Redox-Fluss-Batterien
Die hohe Redoxaktivität des Vanadiums wird technisch als Möglichkeit zur elektrochemischen Energiespeicherung in so genannten Redox-Fluss-Batterien (redox-flow batteries, RFBs) genutzt.[3] Im Gegensatz zu klassischen Batterien werden die Redoxäquivalente in RFBs nicht in festen Elektroden, sondern gelöst im Elektrolyten eingesetzt. Da die Größe der Elektrolyt-Speichertanks frei wählbar ist, können so Akkumulatoren mit fast beliebiger Speicherkapazität entwickelt werden. Die derzeit führende technologische Umsetzung besteht aus einer Vanadium-basierten RFB, in der zwei getrennte Elektrolytzellen über eine Membran und Ableit-Elektroden miteinander verbunden sind (Abb. 2). Eine der beiden Halbzellen verfügt über ein VV/IV-Redoxpaar (häufig VO2+/VO+), die zweite Halbzelle entsprechend ein VIII/II-Redoxpaar (häufig: [V(H2O)6]3+/2+). Beim Beladen der RFB werden Elektronen von der VV/IV-Halbzelle zur VIII/II-Halbzelle transportiert, d.h. es bilden sich die entsprechenden VV und VIISpezies. Der Entladevorgang verläuft entsprechend in entgegengesetzter Richtung. Die Zelle liefert Spannungen im Bereich zwischen 1,2 und 1,6 V, die Energiedichte von ca. 25 Wh/kg liegt jedoch niedriger als vergleichbare Speichersysteme (z.B. Li-Ionen-Akku: ca. 100-200 Wh/kg).[4] Neben den geringen Kosten und ihrer langen Lebenszeit liegt ein Vorteil der Vanadium RFBs in ihrer Skalierbarkeit, so dass stationäre Anlagen mit mehreren Megawatt Leistung z.B. als Zwischenspeicher für Windkraftanlagen oder als Notstromversorgung bereits installiert wurden. Als zukünftige Entwicklung sind mobile Anwendungen in der Elektromobilität denkbar, da der flüssige Elektrolyt im Prinzip analog zu derzeitigem Kraftstoff „nachgetankt“ werden kann. Die für die Elektromobilität notwendige Erhöhung der Energiedichte im Elektrolyten wird derzeit durch Vanadium-Brom-RFBs untersucht, in denen durch erhöhte Löslichkeit der Redoxpartner (in Form von Polyhalogeniden) wesentliche Steigerungen der Energiedichte beobachtet wurden.[5]

3. Molekulare Vanadiumoxid-Chemie
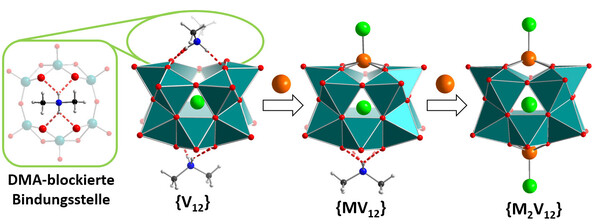
Im Bereich der Vanadium-Verbindungen spielen die Vanadiumoxide eine wichtige Rolle, da sie technisch als Katalysatoren (Schwefelsäure-Herstellung), Sensormaterialien oder Pigmente (Braunglas-Herstellung) genutzt werden. Neben ihrer vielseitigen Festkörper-Chemie sind insbesondere auch molekulare Vanadiumoxide, so genannte Polyoxovanadate aufgrund ihrer vielfältigen Strukturchemie und Reaktivität von besonderem Interesse.[6] Lange Zeit war die Lösungschemie der Vanadate bestimmt durch das Dekavanadat-Ion [HxV10O28](6-x)-, welches in wässriger Lösung über einen weiten pH-Bereich (pH ca. 2-8) die vorherrschende Spezies darstellt. Die bevorzugte Bildung des Dekavanadat-Anions erschwerte jedoch den gezielten Einbau weiterer Metall-Reaktionszentren in Vanadate, so dass die Polyoxovanadat-Chemie lange Zeit hinter der entsprechenden Polyoxowolframat- und -molybdat-Chemie zurückblieb.[7] In den letzten Jahren ist es gelungen, neue Synthesemethoden zu entwickeln, um gezielt die Metallfunktionalisierung von Vanadaten umzusetzen.[8] Ein Schlüssel dazu lag in der Abkehr von traditionellen, wässrigen Synthesen hin zu Cluster-Aufbaurouten in organischen, koordinierenden Lösungsmitteln, wodurch Zugang zu bisher unbekannten Cluster-Architekturen möglich wurde.[9] Eine vor kurzem entwickelte Möglichkeit, kontrolliert reaktive Metalle in Vanadate einzubauen, basiert auf Konzepten der supramolekularen Chemie: Dazu wurde ein Dodekavanadat-Cluster (DMA)2[V12O32Cl]3-genutzt, der über zwei hexagonale Metall-Bindungsstellen verfügt (Abb. 3).[10,11] Diese Bindungsstellen sind im nicht-funktionalisierten Cluster durch Dimethylammonium-Kationen (DMA) über Wasserstoffbrücken „blockiert“, so dass keine ungewollte Metallbindung stattfinden kann. Erst bei Umsetzung mit dem gewünschten Metall-Kation Mn+ erfolgt der Austausch eines oder beider DMA-„Platzhalter“-Kationen. Die Vielseitigkeit des Konzeptes wurde durch den Einbau verschiedenster Metallzentren unter Beweis gestellt und man konnte homogene Katalysatoren und Photokatalysatoren, z.B. für Epoxidierungen und oxidative C-H-Aktivierungen, entwickeln.[10,11] Die Arbeiten zeigen die Vielseitigkeit der Vanadate als molekulare funktionelle Baueinheiten und können neue Wege in der Nutzung dieser Verbindungen in der Katalyse, molekularen Elektronik und Materialchemie eröffnen.
Literatur
M. E. Weeks, J. Chem. Ed. 1932, 9, 863-884
W. Wang, Q. Luo, B. Li, X. Wei, L. Li, Z. Yang, Adv. Funct. Mater. 2013, 23, 970-986.
G. Kear, A. A. Shah, F. C. Walsh, Int. J. Energy Res. 2012, 36, 1105-1120.
M. Skyllas-Kazacos, J. Power Sources 2003, 124, 299-302.
M. T. Pope, A. Müller, Angew. Chem. Int. Ed. Engl. 1991, 30, 34-48.
Spezialausgabe: L. Cronin, A. Müller, (guest eds.), Chem. Soc. Rev. 2012, 41, 7325-7648.
B. Schwarz, J. Forster, M. Goetz, D. Yücel, C. Berger, T. Jacob, C. Streb, Angew. Chem. Int. Ed. 2016, 55, 6329-6333.
J. Forster, B. Rösner, R. H. Fink, L. C. Nye, I. Ivanovic-Burmazovic, K. Kastner, J. Tucher, C. Streb, Chem. Sci. 2013, 418-424.
K. Kastner, J. T. Margraf, T. Clark, C. Streb, Chem. Eur. J. 2014, 20, 12269-12273.
K. Kastner, J. Forster, H. Ida, G. N. Newton, H. Oshio, C. Streb, Chem. Eur. J. 2015, 21, 7686-7689.

Prof. Dr. Carsten Streb
Institut für Anorganische Chemie I Universität Ulm
Das Periodensystem ist ein faszinierendes Ordnungssystem, das die Natur den Elementen gegeben hat. Vor 150 Jahren wurde dieses System erstmals von Wissenschaftlern erkannt. Die Generalversammlung der Vereinten Nationen und die UNESCO haben das Jahr 2019 daher zum International Year of the Periodic Table of Chemical Elements, dem Internationalen Jahr des Periodensystems ausgerufen. Die Elemente des Periodensystems werden in loser Folge vorgestellt.
Bildnachweis Titelbild: Steffen Kristensen, Vanadiumoxidationstates, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons
Dieser Beitrag wurde auf FaszinationChemie erstmalig veröffentlicht am 22.05.2019

Kommentare
Keine Kommentare gefunden!