Tellur – vom paradoxen Gold zum Gewürzmetall

Die Entdeckungsgeschichte des Elements Tellur spielte sich in den letzten beiden Jahrzehnten des 18. Jahrhunderts ab. Der österreichische Chemiker und Mineraloge Franz Joseph Müller von Reichenstein beobachtete 1782 an Golderzen aus Hermannstadt, dem heutigen Sibiu in Rumänien, eine geringere Goldausbeute als erwartet. Man hielt die zusätzlichen enthaltenen Minerale für Antimonsulfid oder Bismutsulfid, was Müller von Reichenstein auf der Basis seiner Experimente jedoch ausschloss. Er vermutete ein neues Metall, dem er die Namen „problematisches Metall“ und „paradoxes Gold“ gab. Geklärt wurden die Fragen erst rund ein Jahrzehnt später, nachdem der Berliner Chemiker Martin Heinrich Klaproth die Proben erhalten hatte. Ihm gelang die Extraktion und erste Reindarstellung des neuen Elements. 1798 würdigte Klaproth zwar Müller von Reichenstein als Entdecker, benannte das Element aber selbst mit dem „nach dem von der alten Mutter Erde (lat. tellus) entlehnten Namen Tellurium“.
Tellur ist auf der Erde ein sehr selten vorkommendes Element. Der Anteil an der Erdkruste beträgt nur 0,001 ppm oder 1 Gramm auf tausend Tonnen Gestein. Damit ist es noch seltener als Gold. Man findet es bisweilen in elementarer Form, vorwiegend jedoch in Form von Tellurmineralien, von denen der Calaverit (Goldditellurid, AuTe2), der Sylvanit (ein gemischtes Silber/Goldtellurid, (Au,Ag)2Te4) und der Tellurit (Tellurdioxid, TeO2) die größte Bedeutung haben. Die häufige Vergesellschaftung des Tellurs mit Erzen der edlen Metalle Kupfer, Silber und Gold sorgt für seine Anreicherung im Produktionsprozess. Bei der Herstellung von Reinkupfer durch elektrolytische Raffination von Rohkupfer wird Tellur im Anodenschlamm als wasserunlösliche Edelmetalltelluride M2Te (M = Cu, Ag, Au) abgeschieden. Pro Jahr werden weltweit nur 180 Tonnen Tellur gewonnen.
Mit dem silbernen Glanz und den scharfen Kanten sind Kristalle von Tellur von ausgesuchter Schönheit (Abb. 1). Sie lassen uns meinen, es sei ein Metall. Allerdings sind die Kristalle weich und spröde. Sie lassen sich leicht zu einem grauen Pulver zermahlen. Bestimmt man die elektrische Leitfähigkeit, zeigt sich eine Verringerung des elektrischen Widerstands mit steigender Temperatur, was das typische Verhalten eines Halbleiters und nicht eines Metalls ist.

Abb. 1: Kristalle von elementarem Tellur (Foto: Johannes Beck, Univ. Bonn).
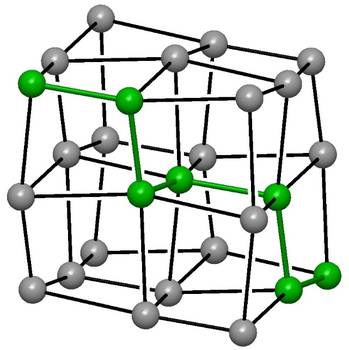
Die Kristallstruktur des Tellurs liefert hierfür eine Erklärung. Es liegen Spiralketten von Telluratomen mit kurzen Abständen innerhalb der Kette von 284 pm vor. Jedes Telluratom hat vier weitere Nachbarn aus benachbarten Spiralketten im Abstand von jeweils 350 pm. Berücksichtigt man alle sechs nächsten Nachbarn eines jeden Telluratoms, ergibt sich eine Anordnung von verzerrten Würfeln (Abb. 2). Im strukturellen Aufbau zeigt Tellur seinen Charakter als Hauptgruppenelement. Die Ausbildung der beiden kurzen, lokalisierten Bindungen eines jeden Telluratoms verhindert die metallische Leitfähigkeit. Beim Übergang in die flüssige Phase, oberhalb des Schmelzpunkts von 450 °C, steigt die Leitfähigkeit sprunghaft um das 15-fache an. Im geschmolzenen Zustand ist die Bindungs- und Elektronenlokalisation nicht mehr vorhanden.
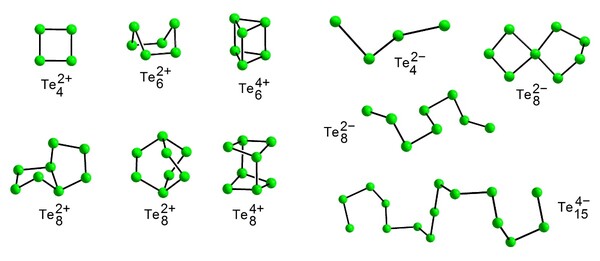
Eine herausragende Eigenschaft des Tellurs ist seine Fähigkeit zur Bildung mehratomiger Kationen und Anionen. Durch gezielte Oxidation oder gezielte Reduktion des Elements lassen sich formal Aggregate aus der Elementstruktur ausschneiden. Geeignete Reduktionsmittel sind unedle Metalle, geeignete Oxidationsmittel Metallhalogenide mit dem Metall in einer hohen Oxidationsstufe wie AsF5 oder WCl6. Auch die elektrochemische Oxidation des Elements ist möglich. Die Zufuhr von Elektronen bei der Reduktion verringert im Mittel die Zahl der Bindungen pro Telluratom, der Elektronenentzug bei der Oxidation erhöht die Zahl der Bindungen im Mittel über zwei. Die gebildeten Strukturen sind überaus vielfältig. Man findet kleine, geladene Moleküle in Form von Ketten, Ringen, verknüpften Ringen oder polyedrischen Clustern (Abb. 3). Es sind neben den molekularen Spezies auch zu unendlichen Ketten, zu Schichten und zu räumlichen Gerüsten vernetzte, polymere Ionen bekannt. Die große strukturelle Vielfalt ist durch die Fähigkeit der Telluratome zur Ausbildung unkonventioneller Mehrzentrenbindungen mit erhöhter Koordinationszahl bedingt.
Die geringe Produktionsmenge deutet an, dass Tellur kein Material für Massenanwendungen ist. Jedoch haben das Element und manche seiner Verbindungen besondere Eigenschaften, die für spezielle Anwendungen interessant sind. So wird Tellur als Legierungsbestandteil vor allem für Kupfer und rostfreien Stahl zur Verbesserung der Bearbeitbarkeit eingesetzt. Gläser aus Tellurdioxid haben hohe Brechungsindices und werden zur Herstellung von Lichtwellenleitern eingesetzt. TeO2-Kristalle dienen als akustooptische Modulatoren zur Manipulation von Laserlicht. Bismuttellurid (Bi2Te3) ist ein Basismaterial für die Herstellung von elektrothermischen Wandlern (Peltier-Elementen), die bei Stromdurchfluss eine Temperaturdifferenz erzeugen oder aus einer Temperaturdifferenz elektrischen Strom generieren. Zentrale Bedeutung für die Datenspeicherung haben Phasenwechselmaterialien in wiederbeschreibbaren Datenträgern wie CD, DVD und Blue Ray Discs. Hierfür werden tellurhaltige Mehrkomponentenlegierungen verwendet, die beim Erhitzen und schnellem Abkühlen amorph erstarren. Die kristalline und die amorphe Phase dieser Substanzen weisen große Unterschiede in der Lichtreflexion auf, was für das Schreiben von Bits genutzt wird (Abb. 4).

Was für Speisen die Gewürze, sind manche metallische Elemente für die moderne Technik. Sie werden nur in kleinen Mengen benötigt, sind aber aufgrund spezieller Eigenschaften nur schwer zu ersetzen oder gänzlich unverzichtbar. Zu diesen „Gewürzmetallen“ zählt man Molybdän, Niob, Tantal, Indium, Gallium, Germanium, Antimon und mehrere Vertreter der Seltenen Erden. Auch Tellur kann in diese Reihe aufgenommen werden. Es wird nur in kleiner Menge gebraucht, hat aber durch die spezifischen Eigenschaften des Elements und mancher seiner Verbindungen einen festen Platz in der Herstellung elektronischer und optischer Produkte.
Literatur
Ch. Schulz, J. Daniels, Th. Bredow, J. Beck, Die elektrochemische Synthese polykationischer Cluster, Angew. Chem. 2016, 128, 1128-1192; Angew. Chem. Int. Ed. 2016, 55, 1173-1177.
E. Ahmed, M. Ruck, Homo- and heteroatomic polycations of groups 15 and 16. Recent advances in synthesis and isolation using room temperature ionic liquids, Coord. Chem. Rev. 2010, 255, 2892-2903.
O. Kysliak, M. Marcus, Th. Bredow, J. Beck, Polytellurides of Mn, Fe, and Zn from Mild Solvothermal Reactions in Liquid Ammonia, Inorg. Chem. 2013, 52, 8327-8333.
W. Bensch, M. Wuttig, Optische Speichermedien und Phasenwechselmaterialien, Chemie in unserer Zeit, 2010, 44, 92-107.
T. Chivers, R. S. Laitinen, Tellurium: a maverick among the chalcogens (Tutorial Review), Chem. Soc. Rev. 2015, 44, 1725-1739.


Kommentare
Sussy Daddy
am 13.06.2022Snens
am 12.06.2024