„Small is beautiful“: Eine Erfolgsgeschichte niedermolekularer Wirkstoffe

Folge 16: Aktuelle Chemie 2019 – Medizin und Gesundheit
Keiner hat es in der Pharmazie so weit geschafft wie sie: kleine niedermolekulare Wirkstoffe (im Englischen small molecules) – Moleküle, deren Masse 800 Gramm pro Mol nicht übersteigt. Sie sind die klassischen Wirksubstanzen, die seit dem Beginn der Wirkstoffentwicklung produziert und verabreicht werden, und stellen bis heute nach Verordnungshäufigkeit über 90 Prozent der auf dem Markt befindlichen Arzneimittel dar. Außer ihrer Größe haben sie nicht viel gemeinsam: Vom klassischen Kopfschmerzmittel bis hin zur modernen Krebstherapie decken die kleinen Alleskönner beinahe jedes Therapiegebiet der Medizin ab. Auch im Zeitalter der molekularen und personalisierten DNA-basierten Medizin erlangen die niedermolekularen Wirkstoffe neue Bedeutung.
Vielfalt als Stärke
Die Synthese von Small Molecules erfolgt durch chemische Reaktionen verschiedener organischer und/oder anorganischer Verbindungen. „Dank chemischer Variabilität können die Moleküle ganz spezifisch auf den Einsatz im Körper hergestellt und angepasst werden“, berichtet Professor Dr. Stefan Laufer, Präsident der Deutschen Pharmazeutischen Gesellschaft (DPhG) und Vorstandsmitglied in der GDCh-Fachgruppe Medizinische Chemie. „Ob Transportmoleküle, Rezeptoren, Ionenkanäle, Enzyme oder DNA das Ziel sind, ob elektrostatische, hydrophobe oder kovalente Bindungen benötigt werden – die biochemische Vielfalt kann mit modernem Drug-Design abgebildet werden.“ Dabei hat die chemische Wirkstoffentwicklung eine lange Geschichte.
Mit Kopfschmerzen fing alles an
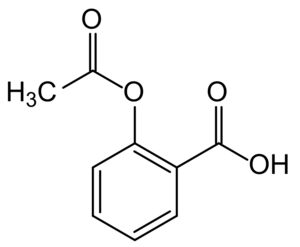
Strukturformel der Acetylsalicylsäure
Bildquelle: 28Smiles, Aspirin-Sructural, CC BY-SA 4.0
Der erste durch chemische Synthese gewonnene, patentierte und auf den Markt gebrachte Wirkstoff war im Jahr 1882 Phenacetin – ein Kopfschmerzmittel, das jedoch aufgrund von Nierentoxizität wieder vom Markt genommen wurde. Wohl bekannter ist eine Verbindung, die wenig später zunächst als Antirheumatikum auf den Markt kam und bis heute eines der am meisten eingenommenen Medikamente ist: die Salicylsäure. Der schmerz- und entzündungshemmende Arzneistoff wurde ab 1874 nach einem von Kolbe und Schmidt entwickelten Verfahren in der Chemischen Fabrik v. Heyden in Radebeul bei Dresden in industriellem Maßstab produziert. Im Jahr 1899 brachten die Farbenfabriken Bayer (heute Bayer AG) den Arzneistoff in chemisch reiner und haltbarer Form (als Acetylsalicylsäure) unter dem Markennamen Aspirin® auf den Markt. Dieses kleine Molekül gehört zur Klasse der nichtsteroidalen Antirheumatika (NSAR). NSAR hemmen die Enzymart der Cyclooxygenasen, die verantwortlich sind für die Bildung von Schmerz-Botenstoffen, den Prostaglandinen. Weniger Prostaglandine bedeuten weniger erregte Schmerzrezeptoren und somit weniger Schmerzempfinden. NSAR werden seit der Markteinführung von Aspirin® stetig weiterentwickelt, sodass es inzwischen viele unterschiedliche und spezifischere Cyclooxigenasehemmer gibt. Aspirin® hat jedoch bis heute kaum an Bedeutung verloren.
Bakterien an die (Erb-)Substanz
„Geradezu bahnbrechend – da lebensrettend! – war auch die Entwicklung von kleinen Molekülen, die schädliche und krankmachende Bakterien angreifen: Antibiotika“, so Professor Laufer. Anfang des 20. Jahrhunderts begann man mit der Erforschung sogenannter Sulfonamide, die Bakterien an der Produktion von Folsäure hindern. Diese benötigen sie für die Herstellung von Nukleotiden, den Grundbausteinen der DNA. Die Sulfonamide töten die Bakterien nicht, hindern diese jedoch an der Vermehrung, indem sie ihre Erbinformation nicht kopieren können. Das erste aus der Erforschung der Sulfonamide resultierende Medikament war 1909 das von Paul Ehrlich zusammen mit dem japanischen Bakteriologen Sahachiro Hata entwickelte Salvarsan, das zur Behandlung von Syphilis eingesetzt wurde. Rund dreißig Jahre später wurden auch die Penicilline entwickelt, die ebenfalls antibiotische Wirkung haben, indem sie Bakterien bei der Synthese ihrer Zellwand stören und so bei der Zellteilung tödliche Wirkung haben. „Viele Derivate dieser Substanzen sind bis heute im Einsatz und werden stetig weiterentwickelt im Kampf gegen Resistenzen“, berichtet Laufer.
Bluthochdruck in den Griff
Mithilfe von Betablockern den Blutdruck im Griff – eine meist dauerhafte medikamentöse Therapie
Bild von Steve Buissinne auf Pixabay
Einen weiteren Meilenstein setzen die in den 1960ern entwickelten Betablocker, eine Reihe ähnlich wirkender Substanzen, die die unter anderem in Herzmuskelzellen vorkommenden β-Adrenozeptoren besetzen. Dadurch können das Hormon Adrenalin und der Neurotransmitter Noradrenalin nicht an den Rezeptor binden, was zu einer Senkung der Ruheherzfrequenz des Herzens und des Blutdrucks führt. Deshalb werden Betablocker bei der medikamentösen Therapie vieler Krankheiten, insbesondere von Bluthochdruck und Koronarer Herzkrankheit, eingesetzt. „Viele weitere Medikamente gegen die Volkskrankheit des Bluthochdrucks sind in den letzten Jahrzehnten dazugekommen“, berichtet Professor Laufer. „Das hat wieder für eine Steigerung der Lebensqualität vieler Menschen geführt – und durch die weite Verbreitung der Krankheit auch insgesamt zu einer Steigerung der Lebenserwartung um etwa ein Jahr.“
Eine starke Mischung gegen Viren
Stilisierte Darstellung eines Virus
Bild von PublicDomainPictures auf Pixabay
In den 1980er-Jahren breitete sich eine andere Erkrankung wie ein Lauffeuer aus: das durch das Humane Immundefizienz-Virus (HIV) ausgelöste „Acquired Immune Deficiency Syndrome", kurz Aids. Bis heute ist die Erkrankung, die das Immunsystem angreift, hochaktuell – das Robert-Koch-Institut schätzte die Zahl der HIV-Infizierten in Deutschland im Jahr 2017 auf insgesamt über 86.000. „Eine Heilung der Krankheit ist bisher nicht möglich. Allerdings hat es in der Wirkstoffforschung auch hier große Fortschritte gegeben. Das Virus lässt sich inzwischen bei regelmäßiger Medikamentierung so in Schach halten, dass Infizierte eine beinahe normale Lebenserwartung bei guter Lebensqualität haben.“ Die HAART-Therapie (kurz für hochaktive antiretrovirale Therapie) besteht aus einer Kombination aus mehreren Wirkstoffen. Diese binden an verschiedene Enzyme, die an der Replikation, also Teilung und Ausbreitung, des Virus beteiligt sind. Das Virus kann sich nicht mehr oder kaum noch teilen, sodass die Viruslast reduziert wird und sich das Immunsystem wieder erholen kann.
„Einen noch größeren Durchbruch gab es in den vergangenen Jahren bei der Viruserkrankung Hepatitis C“, erklärt Professor Laufer. Die durch das Hepatitis C-Virus (HC-Virus) ausgelöste Infektionskrankheit hat schwere Leberschäden zur Folge. Auch hier werden seit Jahren verschiedene Kombinationspräparate zur Behandlung eingesetzt, die unterschiedliche an der Replikation beteiligte Enzyme hemmen und damit das HC-Virus direkt an seiner Vermehrung hindern. Die Heilungsraten liegen zum Teil bei über 99 Prozent, sodass die Krankheit heute als heilbar gilt. „Rechnerisch wäre sogar eine Ausrottung der Infektion in Deutschland innerhalb von 15 bis 20 Jahren denkbar“, ergänzt Laufer.
„The Next Big Thing“: Proteinkinase-Inhibitoren
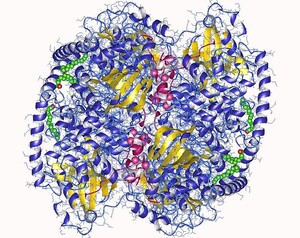
Humaner cAMP-abhängige Proteinkinase mit sechs aktiven Zentren und sechs Inhibitoren (pink)
Deposition authors: Zheng, J., Knighton, D.R., Xuong, N.-H., Taylor, S.S., Sowadski, J.M., Ten Eyck, L.F.;
visualization author: User:Astrojan, 1cmk, CC BY 4.0
„Wer nun meint, man wäre langsam am Ende der niedermolekularen Wirkstoff-Fahnenstange angekommen, der täuscht sich gewaltig“, verrät Professor Laufer. Mit der Entschlüsselung des Humangenoms wurden bereits im Jahr 2002 über 3.000 mögliche Drug Targets, also mögliche Angriffspunkte, für kleine Moleküle ausgemacht (Hopkins, Nature Reviews Drug Discovery 2002: Druggable Genome). Mit den derzeit etwa 4.000 weltweit zugelassenen niedermolekularen Wirkstoffen würden nur etwa 550 der 3.000 Targets erreicht (Santos, Nature Reviews Drug Discovery 2016: A comprehensive map of molecular drug targets).
Besonders aussichtsreich: Proteinkinase-Inhibitoren – Arzneistoffe, die Proteinkinasen hemmen. Darunter versteht man Enzyme, die einem Protein eine Phosphphatgruppe (PO43-) hinzufügen (Phosphorylierung) und es dadurch in den meisten Fällen aktivieren; wenige bestimmte Proteine werden auch deaktiviert. Die starke bzw. unkontrollierte Aktivität der Proteinkinasen spielt vor allem bei malignen, also bösartigen, Tumoren, aber auch bei chronischen Entzündungsprozessen wie Arthrose, eine Schlüsselrolle. Eine Hemmung der unterschiedlichen Proteinkinasen ist damit ein wichtiges Behandlungsprinzip der Krebs- sowie der Arthrosetherapie geworden. Seit dem Beginn der ersten Medikament-Zulassung in diesem Bereich im Jahr 2001 wurden 47 Wirkstoffe auf den Markt gebracht, die unterschiedliche Ansätze und Therapiegebiete verfolgen (Stand April 2019). Auch die Verwendung von Proteinkinase-Inhibitoren zur Behandlung der Alzheimer-Krankheit wird untersucht. „Allein in dem Feld der Proteinkinase-Inhibitoren steckt noch ein riesiges Potenzial für kleine Moleküle. Hier rechne ich in den kommenden Jahren mit weiteren großen Fortschritten“, postuliert Professor Laufer. „Und das ist ja nur ein kleiner Bereich. Personalisierte und DNA-basierte Forschung und Medizin machen heute so viel möglich. Im Angesicht dieser neuen Chancen und Herausforderungen stehen wir auch mit den kleinen Molekülen noch weit am Anfang des Möglichen.“
Hinweis: Dieser Beitrag erhebt keinen Anspruch auf Vollständigkeit, sondern stellt lediglich eine kleine Auswahl erfolgreicher Beispiele aus dem Einsatzspektrum niedermolekularer Wirkstoffe dar.


Kommentare
Franz von Nussbaum
am 17.10.2019Vielen Dank an Frau Hachmann und Stefan Laufer für den schönen Beitrag!
Anne Hachmann
am 22.10.2019