Sepia, Sonnenbräune und Stromkabel – Kupfer ist überall!
2019 - Jahr des Periodensystems
Sepia-Tintenfische schwimmen mit blauem Blut dank Hämocyanin, dessen Schwester-Enzym Tyrosinase für die Bräunung von Haut, Haaren, Federn und Obst verantwortlich ist. Auf der technischen Seite hat Kupfer die menschliche Zivilisation seit 10000 Jahren begleitet, von den ersten Schwertern bis zu den heutigen Koaxial-Stromkabeln und Handys.

Kupferscheibe, Durchmesser ca. 83 mm, Reinheit größer als 99,95 %. Bildnachweis: Alchemist-hp (pse-mendelejew.de), Cu-Scheibe, CC BY-SA 3.0 DE
Das Ende der Steinzeit
Die Verwendung von Kupfer leitete vor 10000 Jahren das Ende der Steinzeit ein. In Ägypten und Mesopotamien wurde Kupfererz gefördert und verhüttet, um das edle Metall für Werkzeuge und Schmuck zu gewinnen. Bereits Ötzi führte ein Kupferbeil mit sich. Dies gelang, weil Kupfer edel ist: Zuerst verwendeten die Menschen natürlich vorkommendes gediegenes Kupfer, bis sie dann in kleinen Öfen mit Holzkohle Kupfererze zu verhütten begannen.
Die Legierung mit Zinn markiert um 3000 v. Chr. den Anfang der Bronzezeit, als die Kupferlegierung für die Waffenherstellung, aber auch für Kunstobjekte, Münzen und Gefäße genutzt wurde. Reines Kupfer ist sehr weich, in Kombination mit Zinn ist es besser für Waffen und Werkzeuge verwendbar. Noch heute werden Bronzelegierungen überall dort eingesetzt, wo Korrosionsbeständigkeit, Verschleißfestigkeit und hohe Elastizität benötigt werden; das reicht von Gleitlagern und Schneckengetrieben bis zur berühmten Glockenbronze. Reines Kupfer besitzt nach Silber die beste elektrische Leitfähigkeit, so dass es in der modernen Elektronikindustrie unverzichtbarer Bestandteil der meisten Kabel ist, z.B. für Transformatorwicklungen und Überlandleitungen, aber auch Stromkabel im Haushalt. Daneben reicht die Breite der Anwendungen von korrosionsbeständigen Regenrinnen und Dächern bis zur Mikroelektronik: Ein durchschnittliches Handy enthält 8.25 g Kupfer. In Legierung mit Zink erhält man Messing, das heute wegen seiner Härte, guten elektrischen Leitfähigkeit und Korrosionsbeständigkeit für Antennen und Armaturen, aber auch Musikinstrumente häufig genutzt wird.
In der Natur wird Kupfer noch viel länger für den Elektronentransfer und den Sauerstofftransport eingesetzt: Schon vor einer Milliarde Jahren verwendeten erste Organismen ein Protein mit zweikernigen Kupfereinheiten - das Hämocyanin, welches den Sauerstoff aus den Atmungsorganen von Weichtieren und Kopffüßlern in die Muskeln transportiert. Jede Krabbe, Spinne oder Schnecke krabbelt also mithilfe des blauen Bluts, einem Dikupferperoxo-Komplex, der auf jeder Seite von drei Histidinen koordiniert ist (Abb. 1). Bei jedem Atmungsvorgang wird also das Dikupferzentrum mit Sauerstoff beladen, das Sauerstoffmolekül zum Peroxid reduziert, zum Muskel transportiert und dort dann wieder abgegeben.
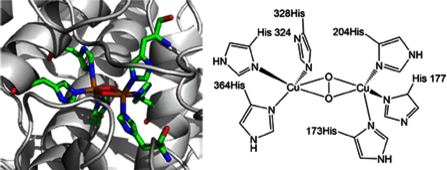
Abb. 1: Dikupferperoxo-Zentrum im Hämocyanin des großen Octopusses [1] (Alexander Hoffman, RWTH Aachen)
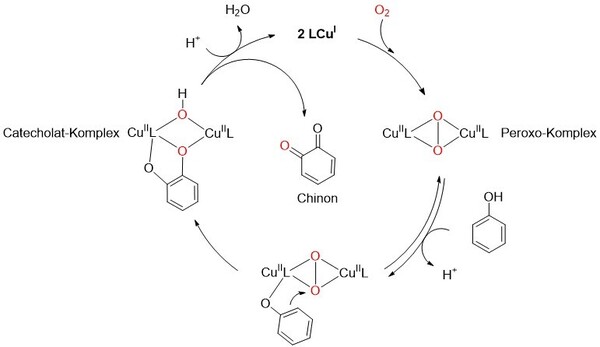
Evolutionär ist dieser Sauerstofftransporter genauso alt wie das Hämoglobin, mit dem die Säugetiere arbeiten. Das Hämocyanin hat einen Doppelgänger, der, bezogen auf das bioanorganische Zentrum, sehr ähnlich aussieht, aber den Sauerstoff nicht nur transportiert, sondern für weitere Reaktionen aktiviert. Dies ist die Tyrosinase, die jedes Lebewesen enthält, das kein Albino ist. Sie vermittelt die Oxidation der essentiellen Aminosäure Tyrosin zum Dopachinon, welches dann weiterreagiert zum Farbpigment Melanin, das unsere Haut und Haare färbt (Abb. 2). Auch die Tinte des Tintenfisches und unsere Leberflecke bestehen aus Melanin, welches in der Evolution des Menschen eine wichtige Rolle bei dem Schutz gegen UV-Strahlung gespielt hat. Des Weiteren werden auch die Bräunung von Obst und Gemüse sowie die Bildung vieler Weinaromen durch Tyrosinase hervorgerufen. Diese Bräunungsprozesse dienen eigentlich als Fraßschutz, sind aber heute meist unerwünscht.
Seit Jahrmillionen Impulsgeber des biologischen und zivilisatorischen Fortschritts
In der bioanorganischen Chemie möchte man nun aus den Prinzipien der Natur lernen, und das Wirkungsprinzip der Tyrosinase auf niedermolekulare Katalysatoren übertragen. Sauerstoff ist das günstigste Oxidationsmittel, wobei die Herausforderung darin liegt, die Oxidationskraft selektiv zu nutzen, also nicht das Substrat zu verbrennen, sondern gezielt eine Hydroxygruppe an einer definierten Position einzubauen. Hier zeigte sich, dass maßgeschneidertes Design der Kupferumgebung essentiell ist, um die effiziente katalytische Hydroxylierung von Phenolen zu vermitteln.[2,3] Die natürliche Umgebung des Histidins kann also mit Pyridin-, Pyrazol- oder Amingruppen nachgebildet werden. So kann der Chemiker das aktive Zentrum der Tyrosinase isoliert betrachten und durch kleine Veränderungen studieren, wie die Reaktivität gesteuert werden kann, um langfristig intelligente und milde Oxidationskatalysatoren zu erhalten.
Da Kupfer sehr leicht den Oxidationsstufenwechsel zwischen +I und +II meistert, werden einige Kupfer-Proteine auch für den biologischen Elektronentransfer verwendet. So z.B. vermittelt das blaue Azurin wichtige Elektronentransferschritte in der Photosynthese, während die Cytochrom-c-Oxidase gemeinsam mit Eisen den Elektronentransfer im letzten Schritt der Atmungskette durchführt. Ohne Kupfer könnten wir also nicht den Sauerstoff aus der Atmung verarbeiten.
Solche Elektronentransferreaktionen sind von grundlegendem Interesse, um Elektronentransportketten zu verstehen und nachzuahmen. Viele Kupferkomplexe können nämlich unter Lichteinwirkung Elektronen an die direkten Nachbarn, also die Ligandenumgebung, abgeben. Daher werden aktuell gerade viele Kupferkomplexe intensiv photochemisch studiert [4,5]. Bei sogenannten Charge-Transfer-Prozessen werden Kupferkomplexe mit Licht angeregt, und ein Elektron springt auf den Liganden. Das verbleibende Kupfer(II)-Zentrum relaxiert ein wenig und konserviert so einen ladungsgetrennten Zustand. Diese Fähigkeit ist wichtig, um für neue Solarzellen günstige Photosensibilisatoren zu entwickeln.
Das Element Kupfer ist also seit Jahrmillionen Impulsgeber des biologischen und zivilisatorischen Fortschritts und wird uns auch in den nächsten Jahrzehnten mit neuen Anwendungen überraschen – ein wahrer Katalysator der Moderne!
[1] M. E. Cuff, K. I. Miller, K.E. van Holde, W. A. Hendrickson, Crystal structure of a functional unit from Octopus hemocyanin, Mol. Biol. 1998, 278, 855.
[2] M. Rolff, J. Schottenheim, H. Decker, F. Tuczek, Copper–O2 reactivity of tyrosinase models towards external monophenolic substrates: molecular mechanism and comparison with the enzyme, Chem. Soc. Rev., 2011, 40, 4077.
[3] A. Hoffmann, C. Citek, S. Binder, A. Goos, M. Rübhausen, O. Troeppner, I. Ivanović-Burmazović, E. C. Wasinger, T. D. P. Stack, S. Herres-Pawlis, Catalytic Phenol Hydroxylation with Dioxygen: Extension of the Tyrosinase Mechanism Beyond the Protein
[4] M. W. Mara, K. A. Fransted, L. X. Chen, Interplays of excited state structures and dynamics in copper(I) diimine complexes: Implications and perspectives, Coord. Chem. Rev. 2015, 282-283, 2-18.
[5] B. Dicke, A. Hoffmann, J. Stanek, M. S. Rampp, B. Grimm-Lebsanft, F. Biebl, D. Rukser, B. Maerz, D. Göries, M. Naumova, M. Biednov, G. Neuber, A. Wetzel, S. M. Hofmann, P. Roedig, A. Meents, J. Bielecki, J. Andreasson, K. R. Beyerlein, H. N. Chapman,

Prof. Dr. Sonja Herres-Pawlis
Institut für Anorganische Chemie, Lehrstuhl für Bioanorganische Chemie, Rheinisch-Westfälische Technische Hochschule Aachen

Dr. Alexander Hoffmann
Institut für Anorganische Chemie, Lehrstuhl für Bioanorganische Chemie, Rheinisch-Westfälische Technische Hochschule Aachen
Das Periodensystem ist ein faszinierendes Ordnungssystem, das die Natur den Elementen gegeben hat. Vor 150 Jahren wurde dieses System erstmals von Wissenschaftlern erkannt. Die Generalversammlung der Vereinten Nationen und die UNESCO haben das Jahr 2019 daher zum International Year of the Periodic Table of Chemical Elements, dem Internationalen Jahr des Periodensystems ausgerufen. Die Elemente des Periodensystems werden in loser Folge vorgestellt.


Kommentare
Keine Kommentare gefunden!