Phosphor – mehr als Bomben, Kampfstoff und Pestizide
Fragt man Leute auf der Straße zu Assoziationen zum Element Phosphor, wird man wahrscheinlich häufig die Schlagworte Brandbomben, Kampfstoffe oder Pestizide hören. Doch ebenso kritikwürdig wie diese Anwendungen sein mögen und das Element negativ belegen, so unverzichtbar ist Phosphat als Düngemittel in der Landwirtschaft.
Entdeckung durch Hennig Brand 1669 aus Urin.
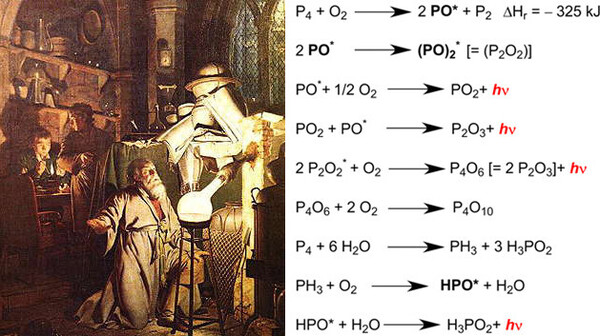
Entdeckt wurde das Element durch Hennig Brand im Jahr 1669, der jedoch eigentlich den Stein der Weisen zu finden gedachte. Dennoch war die Beobachtung des rätselhaften Leuchtens des weißen Phosphors bei Luftkontakt beeindruckend. Heute weiß man, dass dieses namensgebende Phänomen (φως-φóροςphōs-phóros für „lichttragend“) auf die Oxidation von Phosphorsuboxiden mit Luftsauerstoff zurückzuführen ist. Die Phosphor-Chemilumineszenz fand nach ihrer Entmystifizierung als "Mitscherlich Probe"[1] (Eilhard Mitscherlich, 1794-1863) Eingang in die forensische Chemie (Abb. 1).
Heute: Elektro-Schmelzreduktion aus Apatit und drohende Phosphorkrise
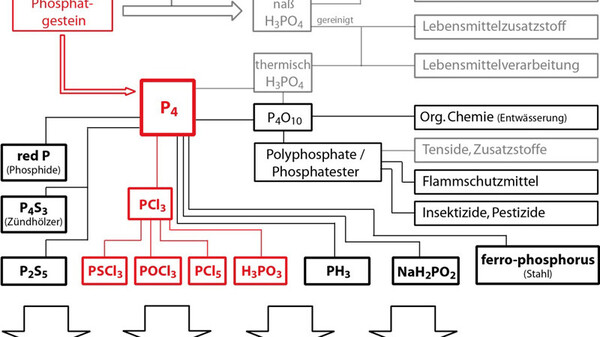
Industriell wird weißer Phosphor durch elektrothermische Reduktion mit Kohle aus Apatit oder Phosphorit hergestellt. Die bekannten Vorkommen an diesen Mineralen, die sich zu 80% auf die vier Länder Marokko, Jordanien, Südafrika und China beschränken, gehen jedoch mittelfristig zur Neige. Manche Endprodukte wie Tenside oder Pestizide mögen adäquat durch phosphorfreie Alternativen ersetzbar sein, wie jedoch sollen die essentiellen Düngemittel ersetzt werden? Eine große Aufgabe ist es, andere Quellen als die begrenzten mineralischen Vorkommen zu erschließen. Denn mit der Knappheit insbesondere Cadmium- und Uran-armer Vorkommen steigt der Preis und damit erscheint die Frage nach der Rentabilität der Düngung besonders in Entwicklungsländern. Naheliegend ist dabei die Einführung einer Kreislaufwirtschaft. Bisher gelangt von Menschen ausgeschiedenes Phosphat überwiegend über das Abwasser in die Umwelt, wo es so stark verdünnt wird, dass eine Rückgewinnung unrentabel erscheint. Ein Ansatz ist die Nutzung des Klärschlamms aus Kläranlagen, welcher dann direkt als Düngemittel recycelt werden könnte. Jedoch gibt es dabei Bedenken über weitere Bestandteile des Schlamms wie etwa Medikamentenrückstände oder Schwermetalle. Dessen Verbrennungsaschen finden jedoch meist nur den Weg in Deponien oder als Füllmaterial in Asphalt oder Beton. Weiterhin sind Gülle, aber auch Knochen ein möglicher Ausgangsstoff für die Rückgewinnung.[4]
Weißer Phosphor
Bekannt ist Phosphor auch für seine Vielfalt an Allotropen. Dabei ist weißer Phosphor jene Modifikation, die das Produkt der großtechnischen Herstellung darstellt (Abb. 2).[5] Phosphor liegt dabei molekular in Form von P4-Tetraedern vor. Weißer Phosphor ist auch Ausgangsstoff für die meisten phosphorhaltigen Folgeprodukte. Dabei erfolgt in der ersten Stufe im Regelfall die Umsetzung mit Chlorgas zur Bildung von PCl3, woraus durch weitere Chlorierung PCl5 oder durch Oxidation POCl3 hergestellt wird. Im Gegensatz zum roten und schwarzen Phosphor ist P4 derart reaktiv, dass es sich an Luft selbst entzündet. Dieser Effekt wird beim Einsatz in Brandbomben genutzt. Deren Verwendung ist durch das Zusatzprotokoll von 1977 der Genfer Konvention stark eingeschränkt. Die USA und Israel haben dieses jedoch nicht unterzeichnet und setzten die Waffen auch in jüngster Zeit im Irak (2004) sowie im Libanon (2006) und im Gazastreifen (2009) ein. Neben der hohen Entzündlichkeit geht auch von der Toxizität eine große Gefahr aus. So liegt die letale Dosis bei nur 1,4 mg je kg Körpergewicht. In der Forschung werden die hohe Reaktivität und der molekulare Aufbau von P4 sehr geschätzt. So lassen sich Phosphorreiche Molekülverbindungen durch die Funktionalisierung dessen aufbauen.[6]
Roter Phosphor
Unter dem Begriff roter Phosphor sind eine Reihe strukturell ähnlicher Modifikationen zusammengefasst, deren Gemeinsamkeit einerseits die Farbe, aber auch der polymere Aufbau ist. Er wird in amorpher Form durch Erhitzen weißen Phosphors auf 260 °C erhalten. Er ist deutlich weniger reaktiv, d.h. luftstabil und zudem nicht toxisch. Derart findet er Verwendung in der Reibefläche von Sicherheitszündhölzern, um beim Reiben des Chlorat-haltigen Zündkopfes das Holz zu entzünden.
Eine kristalline Form ist der Hittorf’sche oder auch violette Phosphor. Erstmals erhalten aus einer Bleischmelze, ist er auch durch Tempern des amorphen roten Phosphors bei 550 °C zugänglich. Während er bei erster Methode das einzige Produkt darstellt, entsteht beim Tempern ebenso der strukturverwandte faserförmige Phosphor. Beide Strukturen sind aus Strängen über P2-Hanteln verknüpfter P8- und P9-Fragmente aufgebaut. Der Unterschied liegt in der Verknüpfung dieser Röhren. Beim Hittorf’schen Phosphor sind sie orthogonal angeordnet und in Schichten verknüpft, während im faserförmigen Phosphor Doppelröhren parallel verknüpfter Stränge vorliegen.[7]
Weitere Varianten des roten Phosphors wurden durch Auswaschen der CuI-Matrix aus (CuI)8P12 und (CuI)3P12 sowie in theoretischen Rechnungen auch aus (CuI)2P14 erhalten.[8] Dabei entstehen Röhren aus P4-Ring-verknüpften P8-Einheiten sowie über P2-Hanteln verknüpften P10- oder P12-Fragmenten. Die Energie der drei Modifikationen liegt jedoch deutlich über den beiden zuvor genannten.[9]
Schwarzer Phosphor
Unter dem Begriff schwarzer Phosphor fallen weitere polymere Festkörperstrukturen zusammen. Gemeinsam ist auch ihnen die Ungiftigkeit. Mit steigendem Druck sind nacheinander von der orthorhombischen, eine trigonale (4,5 GPa), eine kubische (10 GPa), eine modulierte monokline [10], eine hexagonale (137 GPa) und schließlich eine weitere kubische Struktur (258 GPa) zugänglich.[11] Erstere, welche gleichzeitig die bei Standardbedingungen stabile Modifikation darstellt [9], bildet sich bei 200 °C unter 1,2 GPa Druck, wandelt sich jedoch über 550 °C in den Hittorf’schen Phosphor um. Ein einfacher Zugang zu qualitativ hochwertigem kristallinen schwarzen Phosphor auch ohne stark erhöhten Druck aus rotem Phosphor ist bei 600 °C in Gegenwart von Sn, Au und SnI4 möglich. Obwohl thermodynamisch nicht stabil, scheint sich schwarzer Phosphor kinetisch bevorzugt abzuscheiden.[12]
Die orthorhombische Modifikation ist ebenso wie Graphit eine Schichtverbindung. In Analogie zur Exfoilation von Graphen lassen sich auch einzelne Schichten – Phosphoren – isolieren.[13] Dieses ist ebenso wie das Nobelpreis-ausgezeichnete Kohlenstoff-Analogon Gegenstand umfangreicher Forschung auf der ganzen Welt.[14]
Diphosphor
Für synthetische Chemiker spielte die diatomare Form von Phosphor bis in jüngster Zeit nahezu keine Rolle. Sie ist zwischen 1200 und 2000 °C die stabile Modifikation, was Untersuchungen lange Zeit auf die Gasphase beschränkte. Erst im Jahr 2006 wurde das Molekül in Lösung aus einem Niob-Komplex generiert, konnte aufgrund der hohen Reaktivität jedoch nicht frei, sondern nur als Additionsprodukt an Diene untersucht werden.[15] Eine direkte spektroskopische Bobachtung gelingt allerdings in einer Adamant-Krypton Matrix bei 77 K.[16]
Referenzen:
P. A. Hamilton, T. P. Murrells, The Journal of Physical Chemistry 1986, 90, 182-185.
W. Schipper, European Journal of Inorganic Chemistry 2014, 2014, 1567-1571.
O. Ganter, W. Schipper, J. J. Weigand in Sustainable Phosphorus Management, Springer 2014: Spotlight 8, p. 237-242
B. M. Cossairt, N. A. Piro, C. C. Cummins, Chemical Reviews 2010, 110, 4164-4177; M. Caporali, L. Gonsalvi, A. Rossin, M. Peruzzini, Chemical Reviews 2010, 110, 4178-4235; M. Scheer, G. b. Bala?zs, A. Seitz, Chemical Reviews 2010, 110, 4236-4256.
M. Ruck, D. Hoppe, B. Wahl, P. Simon, Y. K. Wang, G. Seifert, Angewandte Chemie-International Edition 2005, 44, 7616-7619.
A. Pfitzner, M. F. Brau, J. Zweck, G. Brunklaus, H. Eckert, Angewandte Chemie-International Edition 2004, 43, 4228-4231.
F. Bachhuber, J. von Appen, R. Dronskowski, P. Schmidt, T. Nilges, A. Pfitzner, R. Weihrich, Angewandte Chemie-International Edition 2014, 53, 11629-11633.
T. Ishikawa, H. Nagara, K. Kusakabe, N. Suzuki, Physical Review Letters 2006, 96.
Y. Akahama, H. Kawamura, S. Carlson, T. Le Bihan, D. Hausermann, Physical Review B 2000, 61, 3139-3142.
S. Lange, P. Schmidt, T. Nilges, Inorganic Chemistry 2007, 46, 4028-4035.
J. R. Brent, N. Savjani, E. A. Lewis, S. J. Haigh, D. J. Lewis, P. O'Brien, Chemical Communications 2014, 50, 13338-13341.
J. Pang, A. Bachmatiuk, Y. Yin, B. Trzebicka, L. Zhao, L. Fu, R. G. Mendes, T. Gemming, Z. Liu, M. H. Rummeli, Advanced Energy Materials 2018, 8, 1702093.
N. A. Piro, J. S. Figueroa, J. T. McKellar, C. C. Cummins, Science 2006, 313, 1276-1279.
A. Kaufmann, 'Homonuclear Cluster u. Wirtsgitter', PhD thesis, 2009, LMU Munich.

Professor Jan J. Weigand, Dr. Felix Hennersdorf
Fachrichtung Chemie und Lebensmittelchemie TU Dresden
Das Periodensystem ist ein faszinierendes Ordnungssystem, das die Natur den Elementen gegeben hat. Vor 150 Jahren wurde dieses System erstmals von Wissenschaftlern erkannt. Die Generalversammlung der Vereinten Nationen und die UNESCO haben das Jahr 2019 daher zum International Year of the Periodic Table of Chemical Elements, dem Internationalen Jahr des Periodensystems ausgerufen. Die Elemente des Periodensystems werden in loser Folge vorgestellt.
Dieser Beitrag wurde auf FaszinationChemie erstmalig veröffentlicht am 20.05.2019


Kommentare
Richard Weihrich
am 30.10.2021Regensburg/Augsburg