Molybdän: Zäh und lebenswichtig, aber nicht offensichtlich

2019 - Jahr des Periodensystems
Knapp 0.1 mg Molybdän täglich benötigt unser Körper für das aktive Zentrum mehrerer Enzyme. In der industriellen Katalyse und im Forschungslabor spalten Molybdänkatalysatoren Alkene an der C=C-Doppelbindung und fügen die Bruchstücke wieder zusammen – aus Propen wird so rasch eine Mischung von Ethen, Propen, cis- und trans-2-Buten. Die katalytische Herstellung von Ammoniak aus atmosphärischem Stickstoff gelingt einer kleinen Gruppe von Mikroorganismen mit Hilfe des molybdänhaltigen Enzyms Nitrogenase, dem wir mehr als die Hälfte der bioverfügbaren Stickstoffverbindungen in der Biosphäre verdanken. Auch im Labor zeigten Molybdänkomplexe Anfangserfolge auf dem Weg zu einer katalytischen Ammoniaksynthese bei Umgebungsbedingungen.
Als Peter Jacob Hjelm 1781 die Reduktion des von Carl Wilhelm Scheele erhaltenen Oxids eines bis dahin unbekannten Metalls mit Kohle gelang, gewann er Molybdän in nicht sehr reiner Form. Das harte Material enthielt Molybdäncarbid und war deshalb so spröde, dass man es nicht verarbeiten konnte. Ende des 19. Jh. wurde die Zähigkeit von Molybdänstahl entdeckt, der bald für die Herstellung von Geschützrohren in großen Mengen benötigt wurde. Reines Molybdän [1] glänzt silbrig, ist härter als Eisen, sehr zäh und hochschmelzend, ritzt Glas jedoch nicht und lässt sich hämmern, feilen und polieren.
Lebenswichtige Funktionen
Die Bedeutung des Molybdäns für lebende Organismen wurde ab 1950 erforscht. Es ist das einzige es-sentielle Metall aus der 4d-Reihe. Die herausragende Rolle dieses Spurenelements für fast alle Lebewesen beruht auf den katalytischen Eigenschaften bestimmter Molybdänverbindungen: Von den Stickstoffverbindungen in der Biosphäre lassen sich ca. 60 % auf die Aktivität des Enzyms Nitrogenase zurückführen. Dieses Enzym enthält einen Eisen-Molybdän-Cluster („FeMo-Cofaktor“) der Zusammensetzung MoFe7S9C [2], (Abb. 1 oben) und wurde lediglich bei manchen Blaualgen und den Knöllchenbakterien der meisten Hülsenfrüchtler (z. B. Erbsen, Erdnüsse und Lupinen) gefunden. Nitrogenase katalysiert die Reduktion von atmosphärischem Stickstoff zu Ammoniak und erzeugt so Stickstoffdünger. Die Rolle des Molybdäns bei dieser Stickstoffaktivierung ist bislang nicht bekannt. Nitrogenasen ohne Molybdän, die entweder Eisen und Vanadium oder nur Eisen im zentralen Metallsulfidcluster enthalten, arbeiten weniger effizient und produzieren mehr Wasserstoff als energieaufwändiges Nebenprodukt. [3]
Im menschlichen Körper befähigt ein Molybdän-Cofaktor („MoCo“, Abb. 1 unten) vier Metalloenzyme (Sulfit-Oxidase, Aldehyd-Oxidase, Xanthin-Oxidoreduktase und ein Amidoxim-reduzierendes Enzym) zur Katalyse lebenswichtiger Redoxreaktionen wie z. B. der Oxidation des giftigen Sulfit-Intermediats aus dem Abbau der schwefelhaltigen Aminosäure Cystein zu Sulfat. Fehlt dieser Cofaktor aufgrund eines Gendefekts, sterben die Patienten häufig im Kindesalter. Insgesamt kennt man über 100 Enzyme, die alle den gleichen Molybdän-Cofaktor „MoCo“ enthalten. [4]
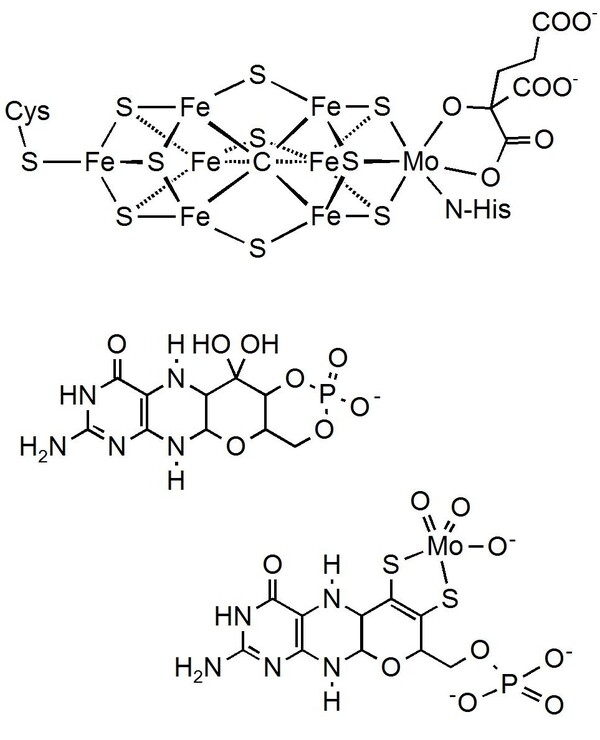
Abb. 1. Oben: Der FeMo-Cofaktor des Enzyms Nitrogenase mit dem Cluster [MoFe7(µ-S)3(µ3-S)6(µ6-C)] und dessen Verknüpfung mit der Proteinmatrix über Cystein und Histidin. Unten: Der Molybdän-Cofaktor (MoCo) und dessen Vorstufe (cyclo-Pyranopterinmonophosphat, cPMP, Mitte). Verhindert ein Gendefekt die Bildung der Vorstufe, so kann das Baby mit cPMP behandelt werden. [4,5] (Helmut Sitzmann, TU Kaiserslautern)
Auch Pflanzen sind auf die lebenswichtigen Funktionen der Sulfit- und Aldehyd-Oxidasen sowie auf Xanthin-Oxidoreduktase angewiesen und verwerten Nitrat mit Nitrat-Reduktasen, die im katalytischen Zentrum den Molybdän-Cofaktor enthalten. Daher gedeihen Pflanzen nur, wenn sie Molybdän aus dem Boden aufnehmen können und tragen dieses Spurenelement in die Nahrungskette ein. Der von der Deutschen Gesellschaft für Ernährung geschätzte Bedarf von 50 – 100 µg pro Tag (ca. 1 % des Molybdäninventars des menschlichen Körpers) wird durch den Molybdängehalt unserer Nahrung leicht gedeckt. Etwa 100 µg Molybdän finden sich z. B. in 140 g Erbsen, 50 g Sojabohnen, 80 g Rotkohl, 45 g Schweineleber oder in 20 g Buchweizen.
Molybdänkatalysatoren für die Olefinmetathese
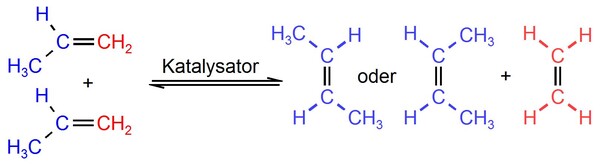
Molybdänkatalysatoren für die Umwandlung von Propen in ein Gemisch von Ethen, Propen und cis/trans-2-Buten [6] werden auch heute noch in der Petrochemie verwendet (Abb. 2). Molekular definierte Molybdän-Alkylidenkomplexe mit hoher Metatheseaktivität wurden in der Arbeitsgruppe Schrock hergestellt und charakterisiert. 1992 konnte Grubbs zeigen, dass Ruthenium-Alkylidenkomplexe im Gegensatz zu den Schrock-Katalysatoren funktionelle Gruppen organischer Moleküle tolerieren. Die Entwicklung der Olefinmetathese zu einem Werkzeug für die synthetische organische Chemie [7] wurde 2005 mit dem Nobelpreis für Chauvin, Schrock und Grubbs gewürdigt.
Molybdänkatalysatoren für die Stickstofffixierung
Als Katalysatoren für die Synthese von Ammoniak unter milden Bedingungen haben sich Molybdänkomplexe in der Grundlagenforschung etabliert. Pionier ist auch auf diesem Gebiet MIT´s Molybdenum Man R. R. Schrock, der 2003 ein Molybdän-Katalysatorsystem vorstellte. [8] Die zunächst noch niedrige Anzahl von vier Katalysecyclen, bei denen pro Molybdänatom acht Ammoniakmoleküle gebildet werden, wurde kürzlich von einem Molybdän-Zweikernkomplex übertroffen, der in der Gruppe von Nishibayashi in einem ähnlichen Experiment auf gut elf Moleküle NH3 pro Molybdänatom kam [9] und durch Austausch eines Stickstoff-Donoratoms des verwendeten Komplexliganden gegen ein Kohlenstoffatom auf 115 Moleküle Ammoniak pro Molybdänatom steigern konnte [10].
Das Mo2-Molekül: Eine ungewöhnliche Bindung
Die 193 pm lange [11] Mo-Mo-Bindung im Dimolybdän-Molekül Mo2 entspricht einer Mo-Mo-Sechsfachbindung mit einer Bindungsenergie von ca. 425 kJ/mol [12]. Zu den fünf Bindungen aus je fünf einfach besetzten 4d-Orbitalen (eine σ-, zwei π- und zwei δ-Bindungen) kommt noch eine σ-Bindung aus den ebenfalls einfach besetzten 5s-Orbitalen der beiden Molybdänatome. [12,13]
Ausblick
Reines Molybdän begegnet uns im Alltag in Form einer Folie, die als elektrischer Leiter in das Quarzglas von Halogenlampen eingeschmolzen wird. Meist bleibt das Molybdän im Hintergrund: Als Tiegelmaterial harmoniert es mit geschmolzenem Aluminiumoxid und könnte helfen, dieses extrem harte Mineral als synthetischen Saphir in Massenanwendungen zu etablieren. Molybdänhaltige Enzyme in lebenden Organismen bergen noch Geheimnisse. In der Industrie und im Forschungslabor werden Molybdän-katalysatoren weiterentwickelt, neue Anwendungen (z. B. Stickstofffixierung) zeichnen sich ab.
Literatur
K. M. Lancaster, M. Roemelt, P. Ettenhuber, Y. Hu, M. W. Ribbe, F. Neese, U. Bergmann, S. DeBeer, Science 2011, 334, 974 – 977.
J. R. Chisnell, R. Premakumar, P. E. Bishop, J. Bacteriol. 1988, 170, 27 – 33.
J. R. Chisnell, R. Premakumar, P. E. Bishop, J. Bacteriol. 1988, 170, 27 – 33.
A. Veldman, J. A. Santamaria-Araujo, S. Sollazzo, J. Pitt, R. Gianello, J. Yaplito-Lee, F. Wong, C. A. Ramsden, J. Reiss, I. Cook, J. Fairweather, G. Schwarz, Pediatrics 2010, 125:e1249-e1254.
R. L. Banks, G. C. Bailey, Ind. Eng. Chem. Prod. Res. Dev. 1964, 3, 170 – 173.
A. H. Hoveyda, S. J. Malcolmson, S. J. Meek, A. R. Zughralin, Angew. Chem. 2010, 122, 38 – 49.
D. V. Yandulov, R. R. Schrock, Science 2003, 301, 76 – 78.
K. Arashiba, Y. Miyake, Y. Nishibayashi, Acc. Chem. Res. 2016, 49, 987 – 995.
A. Eizawa, K. Arashiba, H. Tanaka, S. Kuriyama, Y. Matsuo, K. Nakajima, K. Yoshizawa, Y. Nishibayashi, Nature Communications 2017, 8, 14874 – 14885.
Y. M. Efremov, A. N. Samoilova, V. B. Kozhukhovsky, L. V. Gurvich, J. Mol Spectrosc. 1978, 73, 430 – 440.
B. O. Roos, A. C. Borin, L. Gagliardi, Angewandte Chemie 2007, 119, 1491 – 1494.
Y.-L. Wang, H.-S. Hu, W.-L. Li, F. Wej, J. Li, J. Am. Chem. Soc. 2016, 138, 1126 – 1129.


Benedikt Maaß
Das Periodensystem ist ein faszinierendes Ordnungssystem, das die Natur den Elementen gegeben hat. Vor 150 Jahren wurde dieses System erstmals von Wissenschaftlern erkannt. Die Generalversammlung der Vereinten Nationen und die UNESCO haben das Jahr 2019 daher zum International Year of the Periodic Table of Chemical Elements, dem Internationalen Jahr des Periodensystems ausgerufen. Die Elemente des Periodensystems werden in loser Folge vorgestellt.
Foto oben: Alchemist-hp (talk) (www.pse-mendelejew.de) [FAL or GFDL 1.2], via Wikimedia Commons

Kommentare
pascal
am 16.10.2023pascal
am 16.10.2023