mehr als nur ein Lückenfüller

2019 – Jahr des Periodensystems
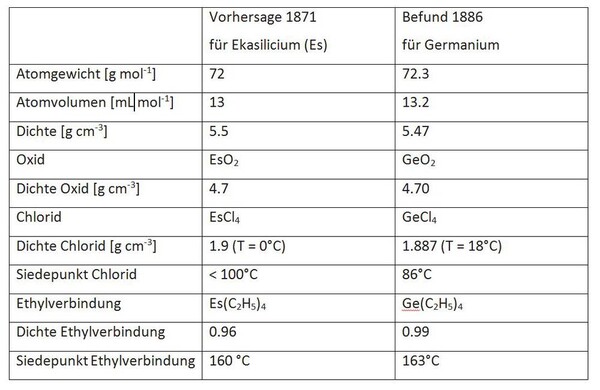
Auf den ersten Blick fristet das Element Germanium in der Gruppe 14 ein Mauerblümchendasein im Schatten der Superstars Kohlenstoff und Silicium und der wirtschaftlich wichtigen Gebrauchsmetalle Zinn und Blei. Doch schon seine Entdeckung war ein Meilenstein für die Entwicklung der modernen Chemie. 1869 war das Jahr, als Dmitri I. Mendelejew und Lothar Meyer parallel zueinander ihre bahnbrechenden Gedanken über den periodischen Zusammenhang zwischen den Eigenschaften der bekannten Elemente und ihrer Atomgewichte, die Grundlage für das moderne Periodensystem der Elemente, veröffentlichten. Der russische Chemiker Mendelejew besaß den Weitblick und die Kühnheit, die offensichtlichen Lücken in seinem „Natürlichen System der Elemente“ mit bislang unbekannten Elementen zu füllen und einige ihrer Eigenschaften und die ihrer Verbindungen vorherzusagen. So postulierte er die Existenz des zur Gruppe 14 gehörenden Elementes Ekasilicium (Es) (das Präfix Eka hat seinen Ursprung im Sanskrit und bedeutet identisch), welches die Lücke zwischen den Elementen Silicium und Zinn füllte. Im Februar des Jahres 1886, 15 Jahre nach dieser Vorhersage, isolierte der Freiberger Chemiker Clemens Winkler aus dem Silbermineral Argyrodit (Ag8GeS6) ein bislang unbekanntes Element, welchem er den Namen Germanium gab. Winkler gelang es auch, erste wohldefinierte Verbindungen des neuen Elements darzustellen. Die beinahe lückenlose Übereinstimmung der für das Ekasilicium vorausgesagten Eigenschaften mit den Befunden an den Germaniumpräparaten Winklers bescherte Mendelejew einen überwältigenden Triumph (Tabelle 1). Es war die Entdeckung des Germaniums, welches die meisten Chemiker von der Richtigkeit des Periodensystems überzeugte.[1]
So betrat das Element Germanium die Weltbühne zwar mit einem Paukenschlag, aber schon Winkler beklagte die schlechte Verfügbarkeit des Elements, die weitere Untersuchungen erschwerte. Zudem erschlossen sich für das seltene nichtmetallische Element zunächst keine technischen Anwendungen. Dieser Zustand währte bis nach dem zweiten Weltkrieg, als aus dem Halbleiter Germanium die ersten Dioden und Transistoren gefertigt wurden. Germanium dominierte die Halbleiterentwicklung bis in die 1970er Jahre hinein, als es zunehmend von Silicium in Nischenapplikationen verdrängt wurde. Eine bemerkenswerte, neue Entwicklung ist der Einsatz von epitaxischen GexSi1-x-Schichten (X = 0 – 0.3) in Hochfrequenzschaltkreisen mit erhöhter Elektronen- und Elektronen¬loch¬mobili¬tät. Dies erlaubt eine weitere Erhöhung der Komplexität von integrierten Schaltkreise auf einem Silicium Chip und somit die Fabrikation schnellerer Prozessoren. Laut dem US-amerikanischen Geological Survey (USGS) wurden 2014 weltweit 30% der Germaniumproduktion (ca. 165 Tonnen) zur Herstellung von Glasfasern zur Lichtwellenleitung benutzt. Hier findet Germaniumdioxid aufgrund seines gegenüber Siliciumdioxid höheren Brechungsindexes Einsatz. Weitere wichtige Einsatzgebiete für Germanium und Germaniumverbindungen sind Infrarotoptiken (20% der Produktion, kristallines Germanium ist transparent für Infrarotlicht), als Polymerisationskatalysator für Polyethylenterephthalate (PET) in der Form von Germaniumdioxid (20%) und zur Herstellung elektronischer Bauteile und Solarzellen (10%).
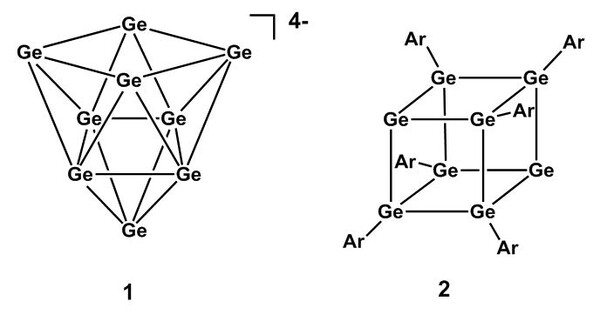
Die besondere Stellung des Germaniums im Periodensystem der Elemente, direkt an der Grenzlinie zwischen Nichtmetallen und Metallen, macht Germaniumchemie zu einem spannenden Forschungsgegenstand, der immer wieder für Überraschungen gut ist. Ein aktiver Forschungszweig der aktuellen Germaniumchemie ist die Synthese und die Untersuchung der Eigenschaften metalloider Clusterverbindungen (s. Abbildung 1). In diesen Clusterverbindungen sind mehrere Germaniumatome miteinander verknüpft und mit zunehmender Größe der Aggregate sind interessante Materialeigenschaften zu erwarten, welche sich deutlich abgrenzen von denen des Festkörpers oder der von molekularen Verbindungen.[2]
Auf der anderen Seite liefert die Chemie des Kohlenstoffs immer wieder die Blaupausen für neuartige, organische Verbindungen des Germaniums. So wurde im Laufe der letzten Jahrzehnte für nahezu jede funktionelle Gruppe der Organischen Chemie das entsprechende Germaniumpendant synthetisiert, aber fast jede dieser neuen Verbindungen behielt seinen spezifischen Germaniumtouch (siehe Abbildung 2). Dieser äußert sich zum Beispiel in der nichtlinearen Anordnung der Atome um die GeGe-Dreifachbindung des Germins 5 (ein Phänomen, welches sich auch in der Si-, Sn- und Pb-Chemie findet) oder in der deutlich geringeren Reaktivität von Carbenanaloga des Germaniums, z.B. des N-heterocyclischen Germylens 6. Das 2008 beschriebene Germaniumdikation des Triflats 8 ist insofern einzigartig, als dass es das erste isolierte Dikation eines Nichtmetalls ist. Der Trick hierbei ist natürlich in der Verwendung des Kryptanden zu sehen, der durch seine Koordination zum Germaniumdikation die Ausbildung kovalenter Bindungen überflüssig macht.
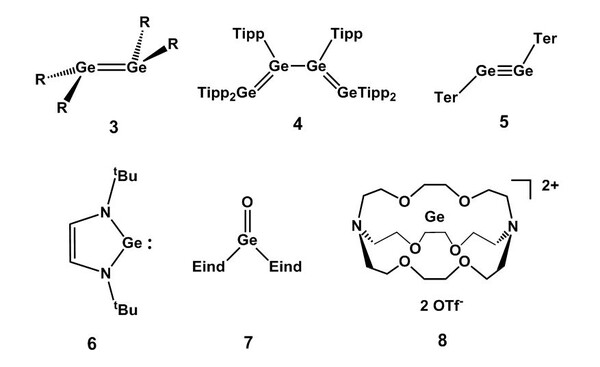
Diese Verbindungen erscheinen ungewöhnlich und oft werden sie als Laborkuriositäten abgetan, sind doch viele thermisch labil und hochreaktiv gegenüber Wasser und Sauerstoff. Aber gerade diese ungewöhnlichen Moleküle können durch ihre besonderen Eigenschaften den Anstoß zu neuen Forschungsrichtungen geben. So stand der erstaunliche Befund, dass das Digermin 5 bei Raumtemperatur mit molekularen Wasserstoff eine Reaktion eingeht, am Anfang einer Renaissance der Hauptgruppenchemie, deren Ziel es ist, neue Katalysatoren für industrielle Prozesse zu finden, welche den Ersatz von teuren, schwermetallhaltigen Übergangsmetallverbindungen durch günstigere, ökologisch unbedenklicher Hauptgruppenelementverbindungen möglich machen könnte. [4]
W. Strube „Der historische Weg der Chemie- Band II“ VEB Verlag für Grundstoffindustrie, Leipzig, 2. Auflage, 1986.
A. Schnepf New J. Chem. 2010, 34, 2079.
V. Ya. Lee, A. Sekiguchi „Organometallic Compounds of Low-Coordinate Si, Ge, Sn and Pb“ Wiley, Chichester, 2010.
P. P. Power Nature 2010, 463, 171

Thomas Müller
Institut für Chemie Carl von Ossietzky Universität Oldenburg
Das Periodensystem ist ein faszinierendes Ordnungssystem, das die Natur den Elementen gegeben hat. Vor 150 Jahren wurde dieses System erstmals von Wissenschaftlern erkannt. Die Generalversammlung der Vereinten Nationen und die UNESCO haben das Jahr 2019 daher zum International Year of the Periodic Table of Chemical Elements, dem Internationalen Jahr des Periodensystems ausgerufen. Die Elemente des Periodensystems werden in loser Folge vorgestellt.
Bildnachweis Titelbild: Zerbor/Stock.adobe.com
Dieser Beitrag wurde auf FaszinationChemie erstmalig veröffentlicht am 20.05.2019.

Kommentare
Keine Kommentare gefunden!