Mangan – Stahlhart und doch essentiell für das Leben

2019 - Jahr des Periodensystems
Während einem Mangan als Legierungsbestandteil von Stahl ganz handfest begegnet, wirkt es an einem essentiellen Prozess des Lebens eher im Verborgenen mit: der Sauerstoffproduktion in photosynthetischen Bakterien, Algen und Pflanzen.
Historische Verwendung, Name und Eigenschaften
Die Verwendung von Manganverbindungen durch den Menschen reicht weit vor die erste Isolierung als Element zurück. So wurde Mangandioxid (MnO2), auch als Braunstein bekannt, auf Grund seiner Farbe bereits in vorzeitlichen Höhlenmalereien als Pigment verwendet. Seit dem Altertum diente dieses Mineral auch als Zusatz in der Herstellung von Glas, da es den grünen Farbstich aus natürlichem Glas entfernen hilft, der auf Spuren von Eisenionen zurückzuführen ist.
Erst 1740 konnte der Berliner Arzt und Chemiker Johann Heinrich Pott (1692–1777) zeigen dass Pyrolusit nicht, wie ursprünglich angenommen, Eisen enthält, sondern ein anderes, noch unbekanntes Element, und daraus Kaliumpermanganat (KMnO4) herstellen. Diese Verbindung ist ein starkes Oxidationsmittel, dessen typische tief rot-violette Farbe auch seine wässrige Lösungen zeigen, die unter anderem Verwendung als Desinfektionsmittel finden. Es dauerte dann jedoch noch fast ein Vierteljahrhundert, bis elementares Mangan schlussendlich durch Johan Gottlieb Gahn (1745–1818), einem schwedischen Chemiker, rein hergestellt wurde, und zwar durch Reduktion von Braunstein mit Kohlenstoff. Der Name leitet sich von der lateinischen Bezeichnung für Braunstein (magnesia nigra) ab, und teilt so mit dem Element Magnesium den geographischen Bezug auf den Bezirk Magnisia in der ostgriechischen Region Thessalien, wo Vorkommen von Mineralien beider Elemente seit dem Altertum bekannt sind.
Mangan ist ein Reinelement mit nur einem stabilen Isotop (55Mn). Daneben sind jedoch noch weitere 25 radioaktive Isotope mit Massenzahlen von 44 bis 69 bekannt, von denen 52Mn, ein β+-Strahler mit einer Halbwertszeit von 21.1 min, für medizinische Anwendungen in der Positronen-Emissionstomographie (PET) untersucht wurde. Metallisches Mangan zeigt eine typische silbergraue Farbe und schmilzt bei 1247 °C. Als unedles Metall wird es von Säuren und langsamer auch von Wasser angegriffen, dabei bildet sich anders als bei Chrom jedoch keine schützende Oxidschicht auf der Oberfläche. Mangan zeichnet sich durch eine große Vielfalt an Oxidationsstufen aus, die zwischen 0 (in metallischem Mangan, aber auch dem Carbonyl-Komplex Mn2(CO)10) und der höchstmöglichen Stufe +VII (in Permanganat, zum Beispiel als KMnO4) liegen, wobei die Stufen +II, +III, +IV und +VII am wichtigsten sind.
Technische Bedeutung
Der Massenanteil von Mangan in der Erdkruste liegt bei 0.1 %, damit ist es das zwölfthäufigste Element und kommt etwa so häufig vor wie Phosphor und Kohlenstoff. Unter den Übergangsmetallen liegt es nach Eisen und Titan an dritter Stelle. Während elementares Mangan in der Natur nicht vorkommt, sind insbesondere oxidische Mineralien wie Braunstein (MnO2), Manganit (MnO(OH)) und Hausmannit (Mn3O4) von Bedeutung, ebenso wie Rhodochrosit (Manganspat, MnCO3) und Rhodonit (MnSiO3). Der Abbau von Manganerzen erfolgt insbesondere in Australien, China und Südafrika, wobei die jährliche Fördermenge bei etwa 10 Millionen Tonnen pro Jahr liegt. Mit geschätzten weltweiten Vorkommen in Höhe von mehr als 3 Milliarden Tonnen ist mit einem Mangel an Mangan daher nicht zu rechnen. Trotzdem wurde immer wieder auch der Abbau sogenannter "Manganknollen", am Meeresgrund zu findender Klumpen mit hohem Anteil des Metalls, diskutiert.
Da elementares Mangan sehr spröde ist, wird der Großteil des industriell gewonnenen Elements als Legierungszusatz für Stahl verwendet. Während normaler Stahl etwa 1 % Mangan enthält, liegt der Anteil bei Manganstahl bei etwa 13 %. Diese extrem harte Legierung wird unter anderem in Eisenbahnschienen, Panzerschränken und Lagern verwendet. Unter den Manganverbindungen sind großtechnisch Mangandioxid (MnO2) und Mangansulfat (MnSO4) von Bedeutung. Mangandioxid findet unter anderem in Alkali-Mangan-Batterien als Energiespeicher Verwendung. Mangansulfat ist Ausgangsmaterial für die elektrolytische Herstellung von reinem Mangan nach 2 MnSO4 + 2 H2O → 2 Mn + 2 H2SO4 + O2.
Biologische Bedeutung
Mangan ist ein essentielles Element für alle Lebewesen, einschließlich des Menschen. Dort ist es insbesondere im aktiven Zentrum der manganhaltigen Superoxid-Dismutase (MnSOD, Abb. 1 links) zu finden, die reaktive Sauerstoffspezies (engl. reactive oxygen species, ROS) wie Superoxid (O2-) zu Wasserstoffperoxid (H2O2) und Sauerstoff umsetzt. Dabei wird ersteres von Katalase-Enzymen, die ebenfalls entweder Mangan oder Eisen im aktiven Zentrum enthalten, weiter zu Wasser und Sauerstoff als harmlosen Endprodukten disproportioniert.
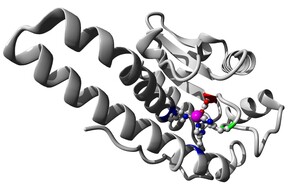
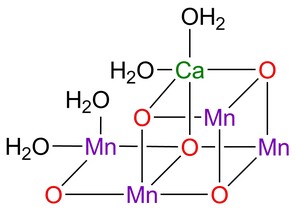
Während Mangan hier also eine wichtige Rolle bei der "Entgiftung" unvollständiger Reduktionsprodukte des Sauerstoff-Stoffwechsels spielt, an dessen Ende die Reduktion von O2 zu Wasser steht, ist es jedoch auch an ganz zentraler Stelle an der photosynthetischen Wasseroxidation beteiligt, die praktisch allen auf der Erde verfügbaren Sauerstoff liefert und die Energiequelle für alle Pflanzen sowie photosynthetische Algen und Bakterien darstellt. Das Photosystem II (PSII) ist ein Multiproteinkomplex, der sich im Inneren von Blättern befindet. Über ein Lichtsammelsystem aus organischen Farbstoffen wird dabei Energie auf einen zentralen Mn4Ca-Cluster, den sogenannten wasseroxidierenden Komplex, übertragen (Abb. 1 rechts). Dieser trägt an einem Mangan- und Calcium-Ion mehrere Wassermoleküle, von denen am Ende des Prozesses zwei nach der Reaktionsgleichung 2 H2O→ 4 H+ + 4 e- + O2 dann ein Molekül Sauerstoff bilden. Die freigesetzten Elektronen dienen dagegen, in Form von NADH gespeichert, als Reduktionsmittel in der Zelle und die Protonen treiben über eine Membran die Synthese von ATP als zentraler Energiequelle der Zelle an.
Medizinische Anwendung
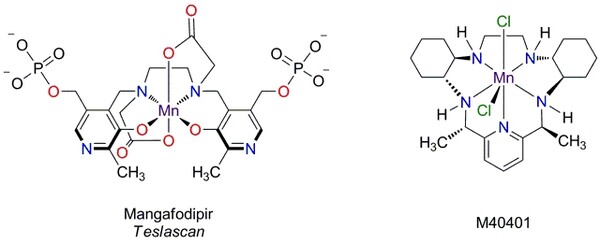
Für die medizinische Bildgebung mit Hilfe der Magnetresonanztomographie (MRT) werden Kontrastmittel benötigt, die eine große Zahl an ungepaarten Elektronen aufweisen. Neben Eisenoxid-Nanopartikeln (engl. superparamagnetic iron oxide nanoparticles, SPIONs) werden insbesondere Gadolinium(III)-Verbindungen verwendet, die mit einer Elektronenkonfiguration von 4f7 die maximale Zahl von ungepaarten Elektronen aufweisen, die bei Lanthanoiden möglich sind. Unter den Übergangsmetallen ist dies unter anderem beim Mangan(II) mit einer Elektronenkonfiguration von high-spin 3d5 der Fall, in der alle d-Orbitale einfach besetzt sind. Ein kommerziell unter dem Markennamen Teslascan verwendeter Mangankomplex ist Mangafodipir (Mn-DPDP), in dem ein Mangan(II)ion von einem N,N′-Bis(pyridoxal-5-phosphat)ethylendiamin-N,N′-diessigsäure-Chelatliganden koordiniert ist (Abb. 2 links). Daneben werden auch synthetische Mangan-Komplexe als Superoxid-Dismutase-Mimetika untersucht (Abb. 2 rechts), die zur Kontrolle von oxidativem Stress, dem beispielsweise eine Rolle bei neurogenerativen Erkrankungen und Entzündungsprozesse zugeschrieben wird, helfen sollen.
Literatur
J. Emsley, Nature's building blocks: An A-Z guide to the elements, Oxford University Press, Oxford, 2011.
Y. Sheng, I. A. Abreu, D. E. Cabelli, M. J. Maroney, A.-F. Miller, M. Teixeira, J. S. Valentine, Superoxid dismutases and superoxide reductases, Chem. Rev. 2014, 114, 3854-3918.
N. Cox, D. A. Pantazis, F. Neese, W. Lubitz, Biological water oxidation, Acc. Chem. Res. 2013, 46, 1588–1596.
J. Yano, V. K. Yachandra, Mn4Ca cluster in photosynthesis: Where and how water is oxidized to dioxygen, Chem. Rev. 2014, 114, 4175-4205.

Prof. Dr. Ulrich Schatzschneider
Institut für Anorganische Chemie, Julius-Maximilians-Universität Würzburg
Das Periodensystem ist ein faszinierendes Ordnungssystem, das die Natur den Elementen gegeben hat. Vor 150 Jahren wurde dieses System erstmals von Wissenschaftlern erkannt. Die Generalversammlung der Vereinten Nationen und die UNESCO haben das Jahr 2019 daher zum International Year of the Periodic Table of Chemical Elements, dem Internationalen Jahr des Periodensystems ausgerufen. Die Elemente des Periodensystems werden in loser Folge vorgestellt.
Titelfoto: Reine (99,99 %) Mangan-Chips, elektrolytisch raffiniert, typisch oberflächlich an der Luft oxidiert, sowie für den Größenvergleich ein reiner (99,99 % = 4N) 1 cm3Mangan-Würfel.
Alchemist-hp (www.pse-mendelejew.de), Manganese; https://creativecommons.org/licenses/by-nc-nd/3.0/deed.de

Kommentare
Keine Kommentare gefunden!