Magnesium – das vielseitige Leichtmetall

2019 – Jahr des Periodensystems
Magnesium hat die Ordnungszahl 12 und ist das zweitleichteste Erdalkalimetall mit den drei stabilen Isotopen 24Mg (78,99 %), 25Mg (10,00 %) und 26Mg (11,01 %). Das mittlere Isotop weist einen Kernspin von +5/2 auf. Dieses Metall ist silbrig-weiß (Abb. 1) und kristallisiert in der hexagonal dichtesten Packung. Es ist ziemlich reaktionsträge und reagiert bei Zimmertemperatur weder mit Sauerstoff noch mit Wasser, wird aber von Säuren angegriffen. Dieses Metall schmilzt bei 650 °C und siedet bei 1090 °C. In der Natur kommt Magnesium stets in der Oxidationsstufe +II vor. Wegen der positiven Elektronenaffinität existieren keine negativen Magnesiumionen. Der Atomradius beträgt 150 pm, der van-der-Waals-Radius ist mit 173 pm nur wenig größer. Die Oxidation führt zu zweiwertigen Magnesiumkationen, die in einer oktaedrischen Umgebung einen Radius von 86 pm aufweisen. Als typisches Metall nimmt die elektrische Leitfähigkeit mit steigender Temperatur ab und der elektrische Widerstand steigt von 39,4 nΩ bei 0 °C auf 277 nΩ bei 700 °C. Magnesium verbrennt mit einer gleißend hellen Flamme unter Bildung des Magnesiumoxids, die Standardbildungsenthalpie ΔG0 (25 °C) von MgO beträgt ‑1139 kJ mol-1, so wird sogar CO2 durch Magnesium zu Kohlenstoff reduziert (Abb. 2).[1,2]

Vorkommen, Entdeckung und Gewinnung


Magnesium kommt in der Natur nicht gediegen, sondern nur in der zweiwertigen Oxidationsstufe vor, wobei die Carbonate [Magnesit oder Bitterspat MgCO3 und Dolomit CaMg(CO3)2 (Abb. 3)], das Halogenid [Carnallit KMgCl3·6H2O], das Sulfat [Kieserit MgSO4·4H2O] und die Silikate [Olivin (Mg,Fe)2SiO4 sowie Talk Mg3Si4O10(OH)2] die wichtigsten Minerale darstellen. Spinelle sind Oxide und weisen die Zusammensetzung MgAl2O4 auf. Schon in der Antike war bekannt, dass die Carbonate in der Hitze Oxide bilden, die Erden genannt wurden. Nach dem Aufschlämmen in Wasser beobachtete man basisches (alkalisches) Verhalten, weshalb diese Metalle (insbesondere Magnesium und Calcium) Erdalkalimetalle genannt wurden. Ein großes Magnesium-Reservoir stellt Meerwasser dar, da 17 % der gelösten Salze Magnesiumverbindungen sind. So gibt es durch die Automobilindustrie angestoßene Bestrebungen, auch in Deutschland Magnesium zu gewinnen: zwei kg können aus einem m3 Nordseewasser gewonnen werden.
Schon 1755 wurde Magnesium von Joseph Black in Edinburgh identifiziert. Die Erstsynthese von Magnesiummetall gelang Sir Humphry Davy bereits 1808 in London durch Salzelektrolyse von Magnesiumhydroxid. Im Jahr 1831 isolierte Antoine-Alexandre-Brutus Bussy (École de Pharmacie in Paris) Magnesiummetall, indem er Magnesiumchlorid mit Kalium reduzierte. Danach löste er Kaliumchlorid mit Wasser heraus und beobachtete glänzende Magnesiumkügelchen. Zwei Jahre später entwickelte Michael Faraday ein elektrolytisches Verfahren zur Herstellung von Magnesiummetall aus den Halogeniden. In den ersten Jahrzehnten des 20. Jahrhunderts wurde in Deutschland für diesen Prozess Carnallit eingesetzt. Später wurde dieses Verfahren für die industrielle Magnesiumherstellung weiterentwickelt. Heute isoliert man Magnesium nach diesem Verfahren in einer Schmelzflusselektrolyse aus Magnesiumchlorid bei 800 °C mit einer Stahlkathode und einer Graphitanode. Hierfür wird gebranntes Magnesiumkarbonat mit Chlor in Anwesenheit von Kohle zu Magnesiumchlorid und Kohlenstoffmonoxid umgesetzt; eine direkte Reduktion von MgO mit Kohlenstoff gelingt hingegen nicht. Im Pidgeon-Prozess wird Magnesiumoxid mit Ferrosilizium bei hohen Temperaturen reduziert. Gehandelt wird Magnesium in 8 kg schweren Barren. Auch das Recycling von Magnesiumlegierungen gewinnt zunehmend an Bedeutung.[1]
Biochemie des Magnesiums
Magnesium ist ein untoxisches und essenzielles Element für alle Lebewesen. Ein Mensch enthält etwa 24 g Magnesium; die Hälfte davon ist in den Knochen an die Hydroxylapatit-Kristalle Ca5(PO4)3(OH) gebunden, weitere 25 bis 30 % befinden sich in den Muskeln. Das restliche Magnesium kommt im Blut und intrazellulär vor. Der tägliche Bedarf liegt bei 250 bis 380 mg. Magnesiummangel entsteht beispielsweise durch Darmresorptionsstörungen und Alkoholismus und kann Krämpfe, Arteriosklerose sowie Herzinfarkte verursachen. Leistungssportler setzen Magnesiumsalze als Nahrungsergänzungsmittel gegen Muskelkrämpfe ein.
In Pflanzen ist Mg2+ (wie auch Ca2+) in den Zellwänden gebunden und dient zum Vernetzen von Proteinen sowie zur photosynthetischen Fixierung von Kohlenstoffdioxid. Magnesiummangel führt zum Verwelken und zur Aufhellung der grünen Blätter. Überdüngung der Böden mit kaliumhaltigen Düngern führt zur Erniedrigung der Magnesiumkonzentration in den angebauten Lebensmitteln. Für die grüne Blattfarbe sind Chlorophylle verantwortlich, Magnesium-Porphyrin-Komplexe, die bevorzugt rotes und blaues Licht absorbieren (Abbildung 4). Die Magnesiumionen sind nur relativ schwach gebunden. Das Herauslösen der Magnesiumionen beim Kochen von Lebensmitteln führt zu einer olivgrünen Verfärbung. Außerdem kann das Magnesiumion durch zweiwertige Kupferionen ersetzt werden, was zu koch- und lichtstabilem Grün führt. Aus diesem Grund wurde grünes Gemüse früher gern in Kupferkesseln zubereitet.[3]

Verwendung
Reduktionsmittel
Magnesiummetall ist ein probates und kostengünstiges Reduktionsmittel und wird technisch unter anderem zur thermischen Reduktion von Metallchloriden zur Herstellung oxophiler Metalle (z.b. Titan, Zirconium, Hafnium, Uran) eingesetzt und in der Eisen- und Stahlindustrie findet es als Desulfurierungs- und Desoxidationsmittel Verwendung.[4] In der organischen Synthesechemie wird die Reduktionskraft des Magnesiums unter anderem in der Pinacol-Kupplung eingesetzt.
Legierungsbestandteil
Magnesium stellt wegen seiner geringen Dichte von nur 1,74 g·cm-3 (um ein Drittel geringer als das Leichtmetall Aluminium) einen beliebten Legierungsbestandteil dar wenn geringes Gewicht von Bedeutung ist wie beispielsweise im Fahrzeugbau, in Luft- und Raumfahrt. Ein weiterer Vorteil ist die leichte Gießbarkeit von flüssigem Metall. Allerdings ist Magnesium nicht korrosionsbeständig und deswegen ist eine Schutzschicht (aus Chrom oder Lack) notwendig. Aus diesem Grund wird Magnesium aber in der Schifffahrt verwendet: Dort schützen magnesiumhaltige Anstriche den Schiffsrumpf vor Korrosion im Salzwasser. Ein weiterer Nachteil ist das Risiko bei Bränden, da Magnesiumbrände nicht mit Wasser gelöscht werden können, sondern mit Sand erstickt werden müssen; daher rührt auch die Anwendung in Brandbomben. Aluminiumlegierungen enthalten oft 2,5 % Magnesium und knapp die Hälfte des produzierten Magnesiummetalls wird als Legierungsmittel verwendet. Ein Auto enthält etwa 15 bis 25 kg Magnesium. Weit größere Anteile werden bei der Luftfahrt zum Bau von Flugzeugen und Hubschraubern verwendet, meist als Legierung mit Aluminium, Zink, aber auch Keramik-Nanopartikeln; die leichteste heute verwendete Legierung enthält beträchtliche Mengen Magnesium und Lithium.[1]
Eine weitere Legierung im Fokus heutiger Forschung sind die Wasserstoffspeichermaterialien, die sich durch Verfügbarkeit, geringe Kosten, geringe Dichte sowie hohe Wasserstoffspeicher-Kapazität auszeichnen. Hierfür werden intensiv Magnesiumlegierungen untersucht, die beispielsweise Nickel, aber auch Kobalt, Mangan und Kupfer enthalten. Die Kinetik der Wasserstoffabsorption und -desorption stellt hier eine zentrale Fragestellung dar. Die Komplexität wird zusätzlich vergrößert, da nicht nur die Legierungszusammensetzung, sondern auch Verfahren der Herstellung und Art der Strukturierung der Legierung von großer Bedeutung sind.
Magnesiumbatterien
Der Energiebedarf der Menschheit wird in der Zukunft steigen, vor allem wegen der stark zunehmenden Elektromobilität. Aus Gewichtsgründen basieren heute viele wiederaufladbare Systeme (Akkumulatoren) auf Lithium und seinen Verbindungen. Zunehmend rückt hier jedoch Magnesium in den Fokus, da dieses Element einige Vorzüge aufweist: Es ist weltweit verfügbar, untoxisch und leicht isolierbar. Außerdem stellt es im Redoxprozess zwei Elektronen zur Verfügung. Die Forschung in diesem Bereich steht noch am Anfang, um große Energiedichten und hohe Sicherheit zu garantieren. Als Elektrolyt scheinen aus heutiger Sicht relativ inerte Etherlösungen die bestgeeignete Wahl zu sein. Außerdem stellen Kathodenmaterial und eine schwer beherrschbare Elektronenübertragungs-Kinetik zukünftige Herausforderungen dar.[5]
Magnesiumorganische Chemie
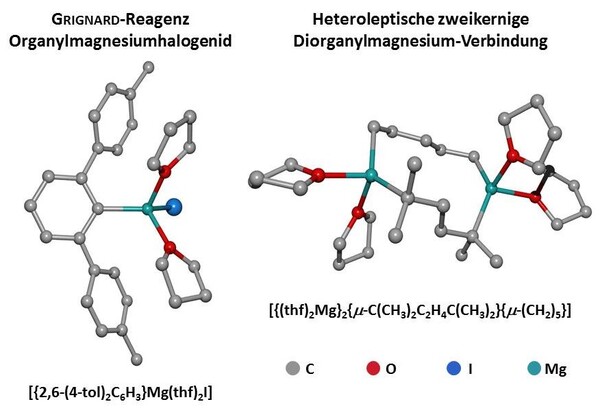
Die Herstellung elementaren Magnesiummetalls ermöglichte den Einsatz dieses Elements in der magnesiumorganischen Chemie. Schon 1866 setzte James Alfred Wanklyn Diethylquecksilber mit Magnesium um und erhielt halogenidfreies Diethylmagnesium.[6] Einige Jahrzehnte später reagierte Philippe Barbier Magnesium mit Alkylhalogeniden.[7] Diese Reaktion wurde von Victor Grignard zur einfachen Synthese von nach ihm benannten Alkylmagnesiumhalogeniden, den Grignard-Reagenzien, weiterentwickelt;[8] ihm wurde für diese Verdienste 1912 der Nobel-Preis verliehen. In der Lösung liegt ein komplexes Gleichgewicht zwischen verschiedenen Organomagnesium-Derivaten und Magnesiumhalogenid vor, das mit Hilfe von 1,4-Dioxan zu Gunsten von Dialkylmagnesium und schwerlöslichem Magnesiumhalogenid verschoben werden kann.[9] Heteroleptische Dialkylmagnesium-Komplexe MgRR‘ sind über Dismutierung der entsprechenden homoleptischen Diorganyle MgR2 und MgR‘2 zugänglich.[10] Trotz der Etablierung von Organomagnesium-Reagenzien als umgepolte Nucleophile in der Synthesechemie vor allem als Transferreagenzien (Carbanionen und Nucleophile) in Additionsreaktionen (Ketone zur Synthese von Alkoholen), Salzmetathesereaktionen (Zugang zu d-Blockmetallorganika), Kreuzkupplungen und Deprotonierungsreagenzien werden diese Verbindungen stetig weiterentwickelt und heutigen Anforderungen in der Synthesechemie angepasst.[11] Die Synthese von Grignard-Reagenzien aus wenig aktivierten C–X-Bindungen sowie bei tiefen Temperaturen gelingt durch den Einsatz von aktiviertem Magnesium Mg*, welches über vielfältige Aktivierungsmethoden zugänglich ist (beispielsweise als Rieke-Magnesium).[11]
Direktes und indirektes Reduktionsmittel
Magnesiumhydrid (MgH2)∞ ist eine salzartige Verbindung mit hoher Gitterenergie und großem Speichervermögen an Wasserstoff, was zum Einsatz in Wasserstoffspeichertechnologien führt. Molekulare, lösliche Magnesiumhydride zeigen ungewöhnliche Hydrierungsreaktionen und Selektivitäten. So lassen sich Pyridin und dessen Derivate katalytisch unter Dearomatisierung zu 1,2-Dihydropyridin umsetzen mit anschließender Hydroborierung.[13]
Alkylmagnesiumverbindungen können auch Reduktionsreaktionen vermitteln: Zum einen in der direkten Reduktion als Elektronentransfer eines Grignard-Reagenzes und zum anderen in der indirekten Reduktion als Konsequenz einer b-Hydrideliminierung der Alkylgruppe und intermediärer Bildung von Magnesiumhydrid.[10]
Im Jahr 2009 publizierte Cameron Jones die erste bei Raumtemperatur stabile, molekulare Magnesium(I)-Verbindung mit einer Mg–Mg-Bindung in [LMg–MgL] (L = DIPPnacnac = CH{(CMe)(2,6-iPr2C6H3N)}2).[14] Trotz Stabilität durch sterischen und kinetischen Schutz der {Mg2}2+-Einheit mittels ß-Diketiminaten (L), bilden sich Addukte mit Lewis-Basen. Durch ihre Reaktivität avancierten diese subvalenten Magnesiumverbindungen schnell zu 2-Zentren-2-Elektronen-Reduktionsmitteln in homogener Phase.[15]
P. Enghag: Encyclopedia of the Elements: Technical Data, History, Processing, Applications, Wiley-VCH: Weinheim, 2005; Kap. 14, S. 315-339.
J. Emsley: Die Elemente, W. de Gruyter: Berlin, 1991; S. 111.
W. Ternes: Biochemie der Elemente, Springer: Berlin, 2013; Kap. 2.2, S. 37-45.
M. Bertau, A. Müller, P. Fröhlich, M. Katzberg: Industrielle Anorganische Chemie, Wiley-VCH: Weinheim, 2013; Kap. 3.1.2.3, S.225-229.
a) J. Muldoon, C. B. Bucur, T. Gregory: Quest for Nonaqueous Multivalent Secondary Batteries: Magnesium and Beyond. Chem. Rev. 2014, 114, 11683-11720; b) J. Song, E. Sahadeo, M. Noked, S. B. Lee: Mapping the Challenges of Magnesium Battery. J. Phys. Chem.
a) J. A. Wanklyn: On a New Method of Forming Organo-Metallic Bodies. J. Chem. Soc. 1866, 19, 128-130; b) J. A. Wanklyn, E. T. Chapman: On Magnesium. J. Chem. Soc. 1866, 19, 141-144.
P. Barbier: Synthèse du Diméthylhepténol. Compt. Rend. Acad. Sci. 1899, 128, 110-111.
V. Grignard: Sur quelques nouvelles combinaisons organométalliques du magnésium et leur application à des synthèses d'alcools et d'hydrocarbons. Compt. Rend. Acad. Sci. 1900, 130, 1322-1324.
A. C. Cope: The Preparation of Dialkylmagnesium Compounds from Grignard Reagents. J. Am. Chem. Soc. 1935, 57, 2238-2240.
R. Fischer, H. Görls, M. Westerhausen: Reactivity Studies of [(thf)2Mg{-C(CH3)2C2H4C(CH3)2}]2: Scambling Reactions and Diverse Reactions with Dichlorophenylphosphane. Organometallics 2016, 35, 3861 – 3869.
S. Krieck, M. Westerhausen in T. P. Hanusa (Ed.): The Lightest Metals: Science and Technology from Lithium to Calcium (Encyclopedia of Inorganic and Bioinorganic Chemistry), Wiley: Chichester, 2015, Part 3, p. 213-229: Reimagining the Grignard Reaction.
S. Krieck, H. Görls, M. Westerhausen: Mechanistic Elucidation of the Formation of the Inverse Ca(I) Sandwich Complex [(thf)3Ca(-C6H3-1,3,5-Ph3)Ca(thf)3] and Stability of Aryl-substituted Phenylcalcium Complexes. J. Am. Chem. Soc. 2010, 132, 124
J. Intemann, M. Lutz, S. Harder: Multinuclaer Magnesium Hydride Clusters: Selective Reduction and Catalytic Hydroboration of Pyridines. Organometallics 2014, 33, 5722 – 5729.
S. P. Green, C. Jones, A. Stasch: Stable magnesium(I) compounds with Mg-Mg bonds. Science 2007, 318, 1754 – 1757.
S. Krieck, L. Yu, M. Reiher, M. Westerhausen: Subvalent Organometallic Compounds of the Alkaline Earth Metals in Low Oxidation States. Eur. J. Inorg. Chem. 2010, 197 – 216.

Prof. Dr. Matthias Westerhausen, Dr. Sven Krieck
Lehrstuhl für Anorganische Chemie I Institut für Anorganische und Analytische Chemie Friedrich-Schiller-Universität Jena
Das Periodensystem ist ein faszinierendes Ordnungssystem, das die Natur den Elementen gegeben hat. Vor 150 Jahren wurde dieses System erstmals von Wissenschaftlern erkannt. Die Generalversammlung der Vereinten Nationen und die UNESCO haben das Jahr 2019 daher zum International Year of the Periodic Table of Chemical Elements, dem Internationalen Jahr des Periodensystems ausgerufen. Die Elemente des Periodensystems werden in loser Folge vorgestellt.
Dieser Beitrag wurde auf FaszinationChemie erstmalig veröffentlicht am 20.05.2019

Kommentare
Pierre Schell
am