Kohlenstoff - King of the Elements

2019 – Jahr des Periodensystems
Carbon – King of the Elements“, wer hat diesen Satz noch nicht gehört? Aber warum ist Kohlenstoff der König/die Königin der Elemente? Was macht die hohe Bedeutung von Kohlenstoff aus?
Da ist zunächst sicher die Tatsache, dass mit Kohlenstoff eine eigene Chemie, die organische Chemie, verbunden ist. Stand 2015 sind geschätzt ca. 100 Millionen chemische Verbindungen bekannt. Die meisten davon rechnet man zu den auf Kohlenstoff basierenden organischen Verbindungen. Auch die wichtigen Moleküle des Lebens (DNA, Zucker, Aminosäuren etc.) enthalten immer Kohlenstoff. Nur ca. 3-5 Millionen Verbindungen gehören zu den anorganischen Verbindungen, von denen die meisten keinen Kohlenstoff enthalten.
Aber das ist es nicht allein! Kohlenstoff tritt in zwei wichtigen Elementmodifikationen auf: Diamant und Graphit. Graphit ist in unserem Leben allgegenwärtig als Mine in Bleistiften oder als Schmiermittel z. B. für Schlösser oder Fahrradketten. Diese Anwendungen basieren auf dem schichtartigen Aufbau von Graphit mit sp2-hybridisierten Kohlenstoffatomen. Innerhalb der Schichten liegen starke kovalente Bindungen vor, und es bildet sich ein planares, bienenwabenartiges Muster mit C6-Ringen. Zwischen den Schichten wirken nur schwache van-der-Waals-Kräfte, so dass die Schichten leicht gegeneinander verschoben werden können. Mit einfachem Klebeband können sogar einzelne Schichten abgelöst werden, und man gelangt so zu Graphen (Abb. 1), das als monolagige Schicht interessante Quantenphänomene zeigt, die weltweit in der Festkörper- und Materialforschung sehr großes Interesse hervorgerufen haben. 2010 wurden Geim und Novoselov für ihre Untersuchungen an Graphen mit dem Nobelpreis für Physik ausgezeichnet.
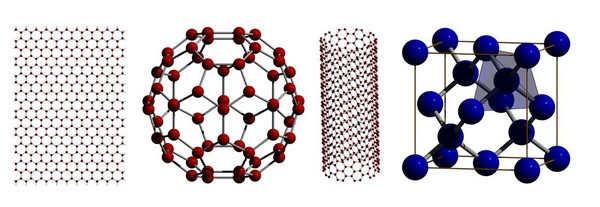
Abb. 1: Elementmodifikationen des Kohlenstoffs (von links nach rechts): Graphen, Fulleren C60, einwandige Kohlenstoffnanoröhren und Diamant. (Uwe Ruschewitz, Univ. Köln)
Ebenfalls mit dem Nobelpreis (1996 für Chemie) wurden Curl, Kroto und Smalley ausgezeichnet, die die Fullerene entdeckten, eine weitere Modifikation des Kohlenstoffs, die sp2-hybridisierte Kohlenstoffatome enthält. Auch hier liegen C6-Ringe vor. Durch den zusätzlichen Einbau von C5-Ringen kommt es aber zu einer schalenartigen Wölbung, die in den Fullerenen zu geschlossenen Hohlkörpern führt. Am bekanntesten und symmetrischsten ist das C60-Molekül (Abb. 1), das aus 12 Fünfecken und 20 Sechsecken aufgebaut ist. Diese Struktur erinnert an alte Fußbälle. Fullerene wurden im Weltall nachgewiesen und spielen z. B. als Elektronen-Akzeptor eine große Rolle in der Materialwissenschaft.
Nimmt man eine einzelne (monolagige) Schicht des Graphens und rollt sie auf, dann gelangt man zu den Kohlenstoffnanoröhren (Abb. 1). Diese können gezielt ein- oder mehrwandig, an den Enden offen oder geschlossen hergestellt werden, wobei die Endkappen „halbe“ Fullerenmoleküle sind. Durch Verzerrung der Röhrenstruktur können die elektrischen Eigenschaften gezielt beeinflusst werden. Es ist deshalb nicht überraschend, dass das Interesse an Kohlenstoffnanoröhren in der Materialwissenschaft ebenso groß ist wie an den Fullerenen und am Graphen.
Doch bei aller Begeisterung über die „neuen“ Kohlenstoff-Modifikationen, die größte Faszination geht sicher immer noch vom Diamant aus. Hier liegen im Gegensatz zu den oben genannten Modifikationen Kohlenstoffatome sp3-hybridisiert und somit tetraedrisch koordiniert vor (Abb. 1). Es bildet sich eine dreidimensionale Festkörperstruktur von enormer Härte, wobei aber die C–C-Bindungen im Diamant bemerkenswerterweise schwächer sind als innerhalb der Graphitschichten. Diamanten werden von der Natur in vielen Millionen Jahren synthetisiert, wobei ihre wahre Schönheit aber erst zum Vorschein kommt, wenn sie durch einen geeigneten Schliff zum Brillanten werden. Aufgrund der enormen Härte gab es ein großes Interesse, sogenannte Industriediamanten im chemischen Labor herzustellen. Dies gelang erstmalig 1953. Im Prinzip benötigt man hohe Drücke und hohe Temperaturen, um in den Bereich des Phasendiagramms des Kohlenstoffs zu gelangen, wo Diamant thermodynamisch stabil ist und nicht mehr, wie bei Normalbedingungen, Graphit. Dies gelingt in hydraulischen Hochdruckpressen, wobei meist ein Katalysator zugesetzt wird, um den Reaktionsdruck und die Reaktionstemperatur zu senken. Diese Katalysatoren verfärben aber den Diamanten und bilden Inklusionen, weshalb die auf diesem Weg dargestellten Diamanten nicht als Schmuckdiamanten geeignet waren. Hier hat es aber in den letzten Jahren viele Verbesserungen gegeben, so dass mittlerweile auch Schmuckdiamanten von hervorragender Qualität künstlich hergestellt werden können.
Da Kohlenstoff neben der sp3- und sp2-Hybridisierung auch eine sp-Hybridisierung aufweisen kann, liegt es nahe, eine weitere Kohlenstoff-Modifikation mit eben sp-hybridisierten Kohlenstoffatomen zu vermuten. In der Tat „geistert“ das sogenannte Carbin (auch: Karbin) schon seit langer Zeit durch die wissenschaftliche Literatur. Hier müssten Kohlenstoff-Ketten vorliegen, die sich gegebenenfalls nach vielen hundert Kohlenstoffatomen zu Ringen schließen, da die Kohlenstoffketten wahrscheinlich nicht exakt linear sind, wie Untersuchungen an molekularen Bruchstücken von z. B. Gladysz und Mitarbeitern ergeben haben.[1] Doch die Nachweise dieser Kohlenstoff-Modifikation sind nicht sehr zuverlässig, so dass man hier am besten den Nobelpreisträger R. Hoffmann zitieren sollte: „Though there has been much work on karbin, our opinion is that it remains a tantalizing mystery.“[2]
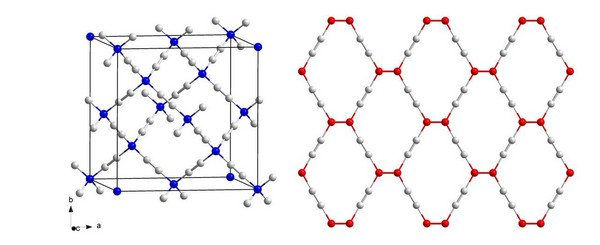
Es ist eine spannende Frage, ob nicht auch andere Kohlenstoff-Modifikationen (auch Allotrope genannt) darstellbar sein könnten, die Kohlenstoffatome in unterschiedlichen Hybridisierungszuständen enthalten. So wäre z. B. ein „Superdiamant“ denkbar, in dem sp3-hybridisierte Kohlenstoffatome tetraedrisch durch Hanteln mit einer C-C-Dreifachbindung und sp-hybridisierten Kohlenstoffatomen verbrückt würden. Eine mögliche Struktur eines solchen Allotrops ist in Abb. 2 (links) gezeigt. Aber auch „Supergraphit-artige“ Schichten aus sp- und sp2-hybridisierten Kohlenstoffatomen sind denkbar (Abb. 2 (rechts)). Darstellen konnte solche Allotrope noch niemand, aber auf den Computern der Theoretiker sind diese und andere sehr wohl schon entstanden.[2,3] Einen interessanten Ansatz verfolgen dabei Diederich und Mitarbeiter: Sie stellen molekulare Baueinheiten her, die als Bruchstücke des gezeigten Superdiamanten und Supergraphits aufgefasst werden können.[4] Dennoch ist es bislang nicht gelungen, diese Baueinheiten zu einem realen neuen Kohlenstoff-Allotrop zu vernetzen.
Kohlenstoff ist also ein spannendes Element, das eine ungeheure Vielfalt an Verbindungen im Bereich der organischen Chemie bildet und zudem hochinteressante Elementmodifikationen mit einem breiten Anwendungsspektrum aufweist. Gibt es auch Kohlenstoff in anorganischen Verbindungen? Diese Frage erscheint müßig, aber wahrscheinlich wird jeder zustimmen, die salzartigen Carbonate wie CaCO3 oder Cyanide wie NaCN dem Bereich der Anorganik zuzuordnen. Interessant sind in diesem Zusammenhang auch Verbindungen, die neben Kohlenstoff nur Metalle oder Halbmetalle enthalten. Man nennt diese Stoffklasse die Carbide. Industriell von großer Bedeutung war Calciumcarbid, CaC2. Da es CºC2--Hanteln mit sp-hybridisierten Kohlenstoffatomen enthält, gehört es zur Unterklasse der Acetylide. Bis weit in die Mitte des letzten Jahrhunderts wurde es in Europa und den USA aus Kohle und gebranntem Kalk, CaO, unter Aufwand enormer Energiemengen im großen Maßstab hergestellt. Es diente sowohl als Acetylenquelle (Acetylen º Ethin, C2H2) als auch als Ausgangsstoff für die Düngemittelindustrie (Kalkstickstoff, CaNCN). Mit dem Aufkommen des Erdöls schwand die Bedeutung von Acetylen z. B. als Ausgangsstoff für die chemische Industrie („Reppe-Chemie“) und somit auch die des CaC2. Erst seit einigen Jahren, bedingt durch die Verknappung des Erdöls, wird wieder verstärkt, vor allem in China, CaC2 produziert, da dort sowohl die benötigten Rohstoffe als auch günstige Energie in Form von Wasserkraft vorhanden sind.
Das C22--Anion, das auch im CaC2 vorliegt, zeigt in Festkörperverbindungen eine überraschende Stabilität, so dass es in vielen Carbiden gefunden wird. So gelang es z. B., die sehr luftempfindlichen Acetylide Na2PdC2 und KAgC2 zu synthetisieren. Diese enthalten neben den C22--Anionen und Na+ bzw. K+ Übergangsmetalle mit der Valenzelektronenkonfiguration 4d10, nämlich Pd(0) bzw. Ag+. Damit in Übereinstimmung wird eine lineare Koordination gefunden, so dass sich unendliche Pd-CºC-Pd- bzw. Ag-CºC-Ag-Ketten ausbilden. Die Kristallstrukturen dieser Verbindungen sind in Abb. 3 gezeigt.
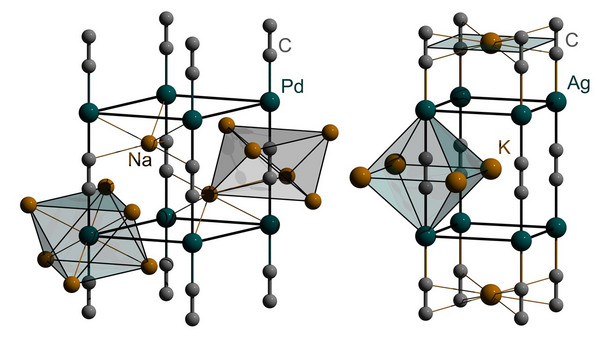
In sehr detaillierten Untersuchungen wurden die C-C-Abstände in den C2-Hanteln der beiden Verbindungen bestimmt. Überraschenderweise weichen sie signifikant voneinander ab: 126,3 pm (Na2PdC2) vs. 122,3 pm (KAgC2). Zum Vergleich: Für eine typische C-C-Dreifachbindung liegt die Bindungslänge bei ca. 120 pm. Diese unterschiedlichen Abstände in den Acetyliden spiegeln sich nun auch in den mit Hilfe der Raman-Spektroskopie ermittelten Frequenzen für die C-C-Streckschwingung wider. Dies bestätigt, dass die C-C-Bindung im Na2PdC2 deutlich schwächer als im KAgC2 ist. Detaillierte theoretische Untersuchungen (Bandstrukturrechnungen) haben nun gezeigt, dass eine Rückbindung vom Metall in die antibindenden Zustände der C2-Einheit vorliegt.[5] Diese Rückbindung ist, wie zu erwarten, vom Pd(0) stärker ausgeprägt als vom geladenen Ag+. Wem das bekannt vorkommt, der liegt völlig richtig: Ein analoges Verhalten wird bei vielen Carbonyl-Komplexen gefunden. Das C22--Anion kann somit als Festkörperanalogon zum CO betrachtet werden. Kürzlich konnte nun erstmalig gezeigt werden, dass Acetylide auch unzersetzt löslich sind, auch wenn das Lösungsmittel, nämlich flüssiger Ammoniak bei tiefen Temperaturen, recht ungewöhnlich ist.[6] Dennoch könnte dies die Möglichkeit zu einer Chemie von Acetyliden in Lösung ermöglichen. Man darf gespannt sein, was hier die Untersuchungen noch ergeben werden.
Referenzen:
W. Mohr, J. Stahl, F. Hampel, J. A. Gladysz, Inorg. Chem. 2001, 40, 3263.
K. M. Merz, Jr., R. Hoffmann, A. T. Balaban, J. Am. Chem. Soc. 1987, 109, 6742.
M. J. Bucknum, R. Hoffmann, J. Am. Chem. Soc. 1994, 116, 11456.
F. Diederich, Y. Rubin, Angew. Chem. 1992, 104, 1123.
U. Ruschewitz, Z. Anorg. Allg. Chem. 2006, 632, 705.
M. Hamberger, S. Liebig, U. Friedrich, N. Korber, U. Ruschewitz, Angew. Chem. 2012, 124, 13181.

Prof. Dr. Uwe Ruschewitz
Institut für Anorganische Chemie, Department für Chemie der Universität zu Köln
Das Periodensystem ist ein faszinierendes Ordnungssystem, das die Natur den Elementen gegeben hat. Vor 150 Jahren wurde dieses System erstmals von Wissenschaftlern erkannt. Die Generalversammlung der Vereinten Nationen und die UNESCO haben das Jahr 2019 daher zum International Year of the Periodic Table of Chemical Elements, dem Internationalen Jahr des Periodensystems ausgerufen. Die Elemente des Periodensystems werden in loser Folge vorgestellt.
Bildnachweis Titelbild: Mario Sarto, Diamant tropfen, CC BY-SA 3.0
Dieser Beitrag wurde auf FaszinationChemie erstmalig veröffentlicht am 06.03.2019.

Kommentare
Keine Kommentare gefunden!