Gold – viel mehr als Schmuck und Zahlungsmittel
2019 - Jahr des Periodensystems
Physik und Chemie der Gold-Nanopartikel (Au-NP) gehören derzeit zu den am meisten bearbeiteten Forschungsfeldern. Diese Aktivitäten sind in einem außerordentlich breiten Anwendungsspektrum begründet, das auch bis in die Biologie und Medizin hineinreicht. [1,2] Stichworte sind in der Physik die größenabhängigen, physikalischen Phänomene der „quantum size effects“ (quantum dots), in der Chemie der Aufbau neuer Materialien aus strukturell und elektronisch wohldefinierten Einheiten, in der Biologie die in mannigfaltiger Weise ansprechbaren Biomarker, und in der Medizin der Einsatz definierter funktioneller Gold-Partikel in Diagnostik und Therapie. Gold als Grundmaterial von Nanopartikeln bringt in der Nanotechnologie viele praktische Vorteile, die primär aus dem gut beherrschbaren „edlen“ Verhalten des Metalls resultieren. Diese Vorzüge machen auch die Oberflächen von elementarem Gold, also die verschiedenen Schnittflächen durch den kubisch flächenzentrierten Gold-Kristall, zu den beliebtesten Spielwiesen der Oberflächentechnik.

Foto: Oktaedrische Goldkristalle aus der Colorado Mine, Kalifornien, USA (Größe 1 cm × 0,9 cm × 0,7 cm) (Rob Lavinsky, iRocks.com – Gold-t06-90a, CC BY-SA 3.0)
Ein Blick in die Vergangenheit
Die bemerkenswerten physikalischen Effekte der Gold-Nanopartikel (früher: Gold-Kolloide) haben den Menschen über mehr als drei Jahrtausende fasziniert. Ohne Kenntnis der materiellen Zusammenhänge haben Handwerker und Künstler bereits im Altertum gelernt, Gold mit empirisch gefundenen Rezepten in feinster Verteilung in Glasflüsse und Keramik einzuschließen und so eine Palette beständiger, leuchtender Farben zu erzeugen. In der Spätzeit der Alchemie und zu Beginn der Chemie als Wissenschaft leisteten vor allem Johann Rudolf Glauber (1604-1670) in Kitzingen am Main, Andreas Cassius (1605-1673) am Hofe des Herzogs von Holstein und Johann Kunckel (1630-1703) am Hofe des Großen Kurfürsten Friedrich Wilhelm von Brandenburg in Potsdam und von König Karl XI von Schweden in Stockholm erste wohl fundierte Beiträge. [3] Die traditionelle Medizin mehrerer Kulturen kannte – oder glaubte an – die heilende Wirkung „trinkbaren Goldes“ (potable gold), das durch Reduktion von Gold-Salzen in Gegenwart von Emulgatoren hergestellt wurde (Gold-Sole). Erst im 19. Jahrhundert setzte sich durch den Einsatz analytischer und spektroskopischer Methoden die Erkenntnis durch, dass die faszinierenden Phänomene wohl kleinen Teilchen des edlen Metalls zugeschrieben werden müssen. Die Vorstellung ging dabei lange dahin, dass die Kerneinheiten der Kolloide kleine Partikel von Goldmetall darstellen, die durch die Hülle aus Emulgatoren und Lösungsmittel getrennt bzw. in der Matrix eines Festkörpers festgehalten sind. Die viel postulierte strukturelle Anordnung der Metallatome im Sinne eines Ausschnitts aus einem Metallgitter blieb jedoch für die gängigen Kolloide lange experimentell unbelegt, und frühe theoretische Berechnungen führten zu widersprüchlichen Ergebnissen.
Gold-Cluster
In ersten ausgedehnten Untersuchungen in den frühen 1980er Jahren wurde in Modellversuchen die Reduktion von Goldsalzen, meist [AuCl4]-, mit Diboran oder Boranaten in Gegenwart von Phosphin-Liganden (R3P = L) studiert [4a, 4b]. Dabei bildeten sich aber meist nur kleine Aggregate – Gold-Cluster – mit geringer Selektivität hinsichtlich der Partikelgröße (also „polydispers"), und die Präparate waren von geringer Stabilität. [4a, 4b] Die erstmals röntgenographisch charakterisierten Beispiele aus dieser Zeit sind die kationischen Komplexe [Au9L8]3+, [Au11L7]3+ und [Au13Cl2L10]3+, deren Strukturen sich von einem Gold-zentrierten Ikosaeder aus Goldatomen ableiten. [4b] Für diese Cluster sind auch die ersten quantenchemischen Modellrechnungen angestellt worden.
Herstellung von Gold-Nanopartikeln
Erst ein Jahrzehnt später wurden die präparativen Techniken der Herstellung von Gold-Nanopartikeln (Au-NPs) stark verbessert und damit eine breite Palette von Produkten mit unterschiedlichen Partikelgrößen zugänglich gemacht. Der Schlüssel zum Erfolg lag in der Verwendung von Thiolen als Hilfsliganden bei der Reduktion der Gold-Salze in einem Zweiphasensystem, weil dadurch die Oberfläche der gebildeten Aggregate von Goldatomen in reproduzierbarer Stöchiometrie mit einer besonders robusten Ligandhülle abgesättigt wird. [6] Durch geeignete Wahl der Thiole und der Bedingungen lassen sich die Au-NPs in verschiedenen, aber jeweils einheitlichen Größen (im Idealfall „monodispers") erhalten. Die luftstabilen Produkte können sogar nach Isolierung wieder in einem Lösungsmittel aufgenommen werden, ohne dass weitere Aggregation zu polydispersen Systemen eintritt. Die intensiven Farben erlauben eine einfache, grobe Kontrolle. Bei Behandlung mit anderen Thiolen tritt Ligandaustausch ein unter weitgehendem Erhalt der Clustergröße.
Das tragende Strukturmotiv
Durch die Kristallisation des Cluster-Anions [Au25(SR)18]- mit R = CH2CH2Ph als Tetraoctylammonium-Salz gelang ein Durchbruch [7], der zu einer neuen Betrachtungsweise der Struktur- und Bindungsverhältnisse führte. [8a] Im Anion ist offensichtlich eine ikosaedrische Kerneinheit (Au13) von einer Schale aus sechs Tri(thiolato)digold(I)-Einheiten [Au2(SR)3]- umgeben. Letztere bilden über ihre terminalen RS-Funktionen feste Klammern zwischen jeweils einem Paar von Gold-Atomen des Kern-Ikosaeders aus. Ihre Goldatome sind weiter auch über aurophile Wechselwirkungen [2] am Cluster fixiert (Abb. 1). Mit anderen Resten R im Thiolat können auch kleinere Klammern [Au(SR)2]- auftreten. Dieses Klammer-Motiv („staple motif“) ist für "monolayer-protected Au-NPs" inzwischen als tragendes Strukturprinzip etabliert. Die Beziehung zwischen Cluster und Hülle entspricht der zwischen einer Gold-Oberfläche und der darauf „selbst-organisierten“ Thiolat-Schicht (self-assembled monolayer, SAM). [8b]
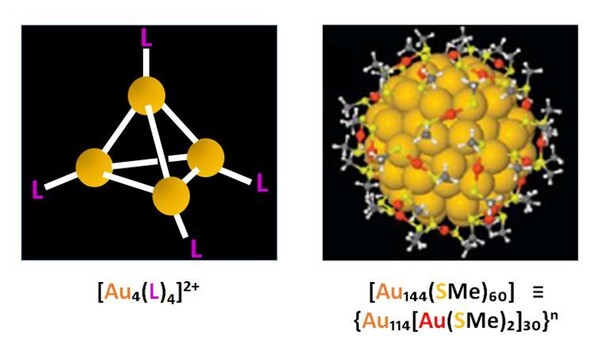
Zur Demonstration der Allgemeingültigkeit des Konzepts war es besonders bedeutsam, dass inzwischen auch die Strukturen weitaus größerer Au-NPs bestimmt werden konnten. Dies gelang bei einem Cluster [Au102(RS)44] mit RS = p-Mercaptobenzoat. [9] Mit p-tButylphenylthiolat wurde schließlich ein Au-NP der Formel [Au133(SR)52] mit ikosaedrischer Kernstruktur erhalten (Abb. 1) [10]. Der Metallkern alleine hat hier bereits einen Durchmesser von 1.7 nm, das ganze NP von 3.4 nm. Für ein Au-NP der Formel [Au144(SMe)60)] mit hoher Stabilität ist ein Goldkern aus 114 Atomen vorhergesagt, der von 30 [Au(SMe)2]-Klammern zusammengehalten wird. [11] (Abb.2.). Durch partielle Substitution der Thiolat-Liganden mit den HS- und RS-Funktionen von Proteinen und DNA gelingt die Fixierung in sogenannten biokonjugaten Formen, etwa durch Angliederung an einen HIV-Inhibitor.
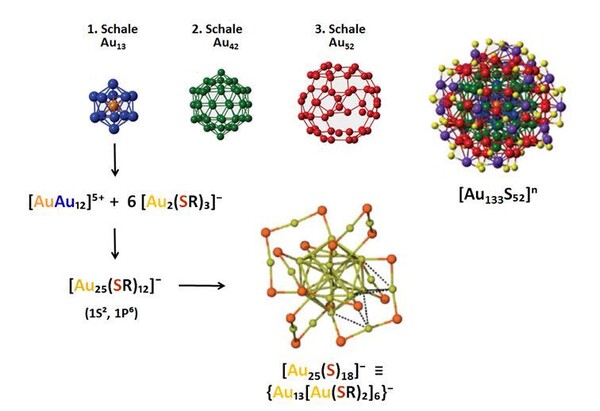
Abb. 1. Schalenaufbau von Au-NPs an den Beispielen [Au133(SR)52] mit R = 4-tBu-C6H4 [9] und [Au25(SR)18]- mit R = PhCH2CH2 [7]
In Fällen, bei denen Röntgenbeugungsuntersuchungen noch nicht möglich waren, wurden hilfsweise NMR-, Mössbauer- und massenspektroskopische Studien betrieben, in jüngster Zeit ergänzt durch die hochauflösenden elektronenmikroskopischen Methoden, bei denen sogar einzelne Atome sichtbar werden. Dabei wurde u. a. ein Au-NP der Formel [Au68(SR)32] gefunden, wobei R für 3-Mercaptobenzoat steht [12]. Eine Mittelstellung zwischen Phosphin- und Thiolat-stabilisierten Au-NPs nimmt der Cluster der Formel [Au25L10(SR)5Cl2]2+ ein, dessen Struktur zwei fünffach Thiolat-verbrückte Gold-ikosaeder mit einer gemeinsamen Ecke aufweist. [13]
Das Superatom-Konzept
Das bemerkenswerteste Ergebnis der Studien an den nun wohldefinierten und strukturell vollständig charakterisierten Au-NPs sind neue Vorstellungen von den Bindungsverhältnissen in ihren zentralen Clustern. [8a] Ausgedehnte DFT-Berechnungen (DFT= Dichtefunktionaltheorie) haben ergeben, dass die Elektronenbesetzung der Cluster einem Aufbauprinzip folgt, das der Besetzung von Orbitalen in einzelnen Atomen entspricht. Es kommt für bestimmte Clustergrößen zu abgeschlossenen Schalen, wie sie z. B. für einzelne Atome bei den Edelgasen gegeben sind. Man spricht deshalb nun von der Besetzung „superatomarer Orbitale“. An die Stelle von Schalenbesetzungen wie z. B. 1s2, 2s2, 2p6 für Argon treten nun Besetzungen 1S2, 1P6, 1D10, 2S2, 1F14...für die Elektronen der Cluster, wobei S, P, D, F wieder die Bahnmomente bezeichnen. Edelgas-ähnliche, abgeschlossene Schalen finden sich dann bei den „Ordnungszahlen“ n = 2, 8, 18, 34, 58, 92, 138... und den diesen entsprechenden Zahlen an Goldatomen, wenn man davon ausgeht, dass jedes Goldatom sein 6s-Orbital zu den Clusterzuständen beiträgt. Die Besetzung 1S2,1P6 gilt dann für die isolierten Ikosaeder von [Au13L10X2]3+, aber auch für die Au13-Kerneinheiten der Anionen [Au25(SR)18]-. Überraschenderweise erklärt sich nach dieser Betrachtungsweise auch die Stabilität von [Au39L14Cl6]n+, da für die Besetzung von 34 Zuständen (1S2, 1P6, 1D10, 2S2, 1F14) die Clustergröße für den abgeschlossenen Zustand dann gerade ausreicht, wenn die Beiträge der Chloratome und der Gesamtladung berücksichtigt werden. Der Cluster mit 58 Goldatomen, der im Au-NP der Formel [Au102(SR)44] vorliegt, hat entsprechend die Besetzung 1S2, 1P6, 1D10, 2S2, 1F14, 2P6, 1G18. In allen Fällen ist zu beachten, dass nur die Goldatome der Kernzone in die Abzählung einbezogen werden dürfen, nicht aber solche in der Ligand-Hülle (der [Au(SR)2]-Klammern). Mit diesen verblüffenden Übereinstimmungen hat die „Edelgas-Superatom Analogie“ eine erste Gültigkeitsprobe bestanden. Über das Superatom-Konzept lassen sich auch viele der physikalischen Eigenschaften der Au-NPs nachvollziehen. Das gilt auch für Au-NPs mit teilweiser „Legierung“ der [Au13]-Kerneinheit mit Kupfer- oder Silber-Atomen. [14]
Das neue Konzept löst vorerst eine Vorstellung vom Aufbau von Gold-Clustern ab, die sich nur auf die strukturellen Voraussetzungen bezogen hatte. [4a, 15a,b] Demnach sollte sich die Aggregation mit einfachen Regeln des Schichtaufbaus nachvollziehen lassen. Dieser sieht in der Umhüllung eines einzelnen Atoms durch 12 weitere Atome in ikosaedrischer Anordnung zwar zunächst ebenfalls einen [Au13]-Cluster vor, erreicht aber als Stufe mit kompletter zweiter Schale schon den [Au55]-Cluster, gefolgt von[Au147], [Au309], [Au561] usw. (Abb.3.). In frühen Arbeiten wurde zwar ein Cluster [Au55L12Cl6] beschrieben (L = PPh3) [4a], seine Zusammensetzung und Struktur sind aber bis heute nicht endgültig geklärt, da die Synthese offenbar kein monodisperses Material liefert, und die Produkte von geringer Stabilität sind. Es bleibt also fraglich, ob die dort zugrunde gelegten „magischen Zahlen“ 1, 13, 55, 147... tatsächlich Indikatoren sind, die Au-NPs bevorzugter Stabilität finden lassen. In jüngster Zeit gilt das Interesse vermehrt dem Übergang vom excitonischen zum plasmonischen Verhalten großer Gold-Cluster. Dieser ist gleichbedeutend mit dem Auftreten von genuin metallischem Charakter, der in Abhängigkeit von der Natur der Thiolat-Liganden bei Clustergrößen von ca. 280 Goldatomen erreicht wird. Die Struktur entspricht dann auch dem kubisch-flächenzentrierten Modell des Metalls. [16]

In jüngsten Arbeiten wurden auch die kleinsten, denkbaren Aggregate von Goldatomen durch den Einsatz neuer Liganden zugänglich. Hervorzuheben sind die stabilen Komplexe eines oder zweier Goldatome durch je zwei besonders Donor-fähige und sterisch abschirmende Carbene : [(CAAC)Au(CAAC)]0 und [(CAAC)Au-Au(CAAC)]0 (CAAC = cyclic alkyl(amino) carbene). [17] Damit wurden die beiden im Gold-Dampf überwiegend vorhandenen Teilchen [Au]·und [Au2]0 als metallorganische Komplexe isoliert. Im Bereich der kleinen Cluster ist schließlich das tetraedrische Aggregat [Au4L4]2+ bemerkenswert. [18a] Seinem [Au4]-Superatom kommt offensichtlich die einfachste Elektronenstruktur 1S2(A1g) zu (Abb. 2). Die nachfolgenden Clustergrößen [Au5] und [Au6] können ihre superatomaren Orbitale auch mit den Elektronen von Interstitial-Atomen besetzen [5]. Besonders hohe Stabilität findet sich demnach z. B. bei Kationen des Typs [Au5C(L)5]+ und [Au6C(L)6]2+ mit C-zentrierten trigonalen Bipyramiden bzw. Oktaedern. [18b,c]
M.-C. Daniel, D. Astruc, Chem. Rev. 2004, 104, 293-346.
G. J. Hutchings, M. Brust, H. Schmidbaur, Chem. Soc. Rev. 2008, 37, 1759; an editorial to a special issue on gold chemistry.
C. B. Hunt, Gold Bulletin 1976, 9, 134.
a) G. Schmid, Chem. Soc. Rev. 2008, 37, 1909. b) C. E. Briant, B. R. C. Theobald, J. W. White, L. K. Bell, M. P. Mingos, J. Chem. Soc., Chem. Comm. 1981, 201.
D. M. P. Mingos, J. Chem. Soc., Dalton Trans. 1976, 1163.
M. Brust, J. Fink, D. Bethell, D. J. Shiffrin, C. Kiely, J. Chem. Soc., Chem. Comm. 1995, 1655.
M. W. Heaven, A. Dass, P. S. White, K. M. Holt, R. W. Murray, J. Am. Chem. Soc. 2008, 130, 3754.
a) M. Walter, J. Akola, O. Lopez-Acevedo, P. D. Jadzinsky, G. Calero, C. J. Ackerson, R. L. Whetten, H. Grönbeck, H. Häkkinen, PNAS 2008, 105, 9157. b) J. C. Love, l. A. Estroff, J. K. Kriebel, R. G. Nuzzo, G, M. Whitesides, Chem. Rev. 2005, 105, 11.03.
Y. Levi-Kalisman, P. D. Jadzinsky, N. Kalisman, H. Tsunoyama, T. Tsukuda, D. A. Bushnell, R. D. Kornberg, J. Am. Chem. Soc. 2011, 133, 2976.
A. Dass, S. Theivendran, P. R. Nimmala, C. Kumara, V. R. Jupally, A. Fortunelli, L. Sementa, G. Barcaro, X. Zuo, B. C. Noll, J. Am. Chem. Soc. 2015, 137, 4610.
O. Lopez-Acevedo, J. Akola, R. L. Whetten, H. Grönbeck, H. Häkkinen, Phys. Chem. Lett. C 2009, 113, 5035.
M. Azubel, J. Koivisto, S. Malola, D. Bushnell, G. L. Hura, A. L. Koh, H. Tsunoyama, T. Tsukuda, M. Pettersson,H. Häkkinen, R. D. Kornberg, Science 2014, 345, 909.
Y. Shichibu, Y. Negishi, T. Watanabe, N. K. Chaki, H. Kawaguchi, T. Tsukuda, J. Phys. Chem. C 2007, 111, 7845.
D. Jiang, S. Dai, Inorg. Chem. 2009, 48, 2720.
a) J. D. Aiken III, R. G. Finke, J. Mol. Catal. A Chemical 1999, 145, 1. b) R. Balasubramanian, R. Guo, A. J. Mills, R. W. Murray, J. Am. Chem. Soc. 2005, 127, 8126;
T. Higaki, M. Zhou, K. J. lembright, K. Kirschbaum, M. Y. Sfeir, R. Jin, J. Am. Chem. Soc. 2018, 140, 5691.
D. S. Weinberger, M. Melaimi, C. E. Moore, A. L. Rheingold, G. Frenking, P. Jerabek, G. Bertrand, Angew. Chem. Int. Ed. 2013, 52, 8964.
a) E. Zeller, H. Beruda, H. Schmidbaur, Inorg. Chem. 1993, 32, 3203. b) F. Scherbaum, A. Grohmann, B. Huber, C. Krüger, H. Schmidbaur, Angew. Chem. Int. Ed. 1988, 27, 1544. c) F. Scherbaum, A. Grohmann, G. Müller, H. Schmidbaur, Angew. Chem. Int. Ed. 19

Prof. em. Dr. Dr. h.c. Hubert Schmidbaur
Department Chemie, Technische Universität München

Das Periodensystem ist ein faszinierendes Ordnungssystem, das die Natur den Elementen gegeben hat. Vor 150 Jahren wurde dieses System erstmals von Wissenschaftlern erkannt. Die Generalversammlung der Vereinten Nationen und die UNESCO haben das Jahr 2019 daher zum International Year of the Periodic Table of Chemical Elements, dem Internationalen Jahr des Periodensystems ausgerufen. Die Elemente des Periodensystems werden in loser Folge vorgestellt.


Kommentare
Keine Kommentare gefunden!