Die Alzheimer-Erkrankung – ein rätselhafter Kriminalfall (Teil I)

Folge 17: Aktuelle Chemie 2019 - Medizin und Gesundheit
Die Alzheimer-Krankheit (lateinisch Morbus Alzheimer) ist eine neurodegenerative Erkrankung, die für ca. 60 bis 80 Prozent der weltweit etwa 24 Millionen Demenzerkrankungen verantwortlich ist. In Deutschland leiden etwa 1,7 Millionen Menschen unter einer Demenzerkrankung (Zahl 2017, Deutsche Alzheimer Gesellschaft e.V.); jedes Jahr kommen ca. 300.000 neu Diagnostizierte dazu. Es gibt bekannte Faktoren, die das Krankheitsrisiko erhöhen, aber die Ursache kennt man nicht. Der Bedarf an einer wirksamen Therapie ist enorm – bisherige Medikamente wie Acetylcholinesterase-Hemmer, Memantin oder Ginkgo-Präparate können allenfalls manche Symptome lindern oder ihr Auftreten etwas hinauszögern, die Krankheit aufhalten können sie nicht. In den vergangenen Monaten gingen einige vielversprechende Wirkstoffkandidaten wie Aducanumab, Bapineuzumab oder Umibecestat ins Rennen der klinischen Phase III Erprobung – doch alle scheiterten sie. Eine Wirksamkeit konnte nicht nachgewiesen werden. Damit reihen sie sich in eine lange Liste von gescheiterten Versuchen (1998 bis 2017: 150 Stück), der schleichenden Gehirnerkrankung Herr zu werden.
Tatort Gehirn
Im Jahr 1906 entdeckte der Psychiater und Neuropathologe Alois Alzheimer unter dem Mikroskop am Gehirn eines Verstorbenen die für Alzheimer charakteristischen Ablagerungen im Gehirn, die „Plaques“. Diese sind ein typisches Merkmal und unterscheiden die Alzheimer-Demenz von anderen Formen der Demenz. Die Zusammensetzung der „Plaques“ ist heute bekannt: Sie bestehen aus Amyloid-β-Proteinen (kurz Aβ), die sich zusammenlagern und verklumpen. Viele Forscher sahen und sehen diese Aβ-Plaques als Ursache für Alzheimer, Amyloid-Hypothese genannt. Auf ihrer Basis wurden vor allem Medikamente entwickelt, die diese Verklumpungen auflösen sollten. Was im Mausmodell vielversprechend aussah, konnte in der klinischen Erprobung jedoch nicht bestehen. „Das wundert mich überhaupt nicht“, erklärt Professor Dr. med. habil. Thomas Arendt, Geschäftsführender Institutsdirektor am Paul-Flechsig-Institut für Hirnforschung des Universitätsklinikums Leipzig und Vorsitzender des Wissenschaftlichen Beirats der gemeinnützigen Alzheimer Forschung Initiative e.V. (AFI). „Wenn Sie vor einem abgebrannten Haus stehen, können Sie auch nicht anhand der Aschehaufen das Haus rekonstruieren. Sie können nicht einmal auf dessen früheres Aussehen schließen, nicht auf die Personen, die darin lebten und auch nicht auf den Prozess, der dazu geführt hat, dass das Haus abgebrannt ist. Genau an dem Punkt befinden wir uns in der Alzheimerforschung: ganz am Anfang (eines rätselhaften Kriminalfalls).“

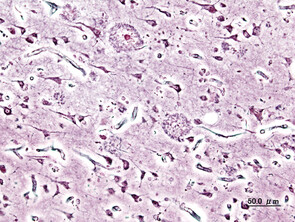
Ob vor den Überresten eines verbrannten Hauses oder dem histopathologischen Bild eines Alzheimergehirns mit Plaques: Der Tathergang ist schwierig zu rekonstruieren.
Bild oben von Myriam Zilles auf Pixabay, Bild unten User:KGH, Alzheimer dementia (3) presenile onset, CC BY-SA 3.0
Tücken bei der Aufklärung
Es gibt verschiedene Herausforderungen, denen man in der Alzheimerforschung gegenübersteht und die Alzheimer von anderen Demenzerkrankungen unterscheidet, wie Professor Arendt im Folgenden:
1. Der Schädel als Barriere
„Das Gehirn befindet sich in der knöchernen Hülle des Schädels, sodass eine direkte Untersuchung am lebenden Patienten nur sehr eingeschränkt möglich ist. Viele Untersuchungen am Gehirn sind nur nach dem Ableben des Patienten möglich, sodass wir dann einen Zustand vor uns haben, der mit dem Leben bereits nicht mehr vereinbar war. Von diesem Zustand aus ist es sehr schwierig, auf einen um Jahrzehnte jüngeren Organismus und den bis hierhin verlaufenen Prozess zu schließen.“
2. Ein langer Prozess
„Hier klingt schon die nächste Herausforderung an: Die Erkrankung verläuft sehr langsam und in ihren Anfangsstadien klinisch stumm, also ohne Symptome. Man geht in der Wissenschaft davon aus, dass die Erkrankung, ehe sie anhand ihrer ersten Symptome diagnostiziert werden kann, bereits seit mehreren Jahrzehnten und vielleicht sogar seit der Geburt im Körper abläuft. Wenn wir nun die Krankheit verstehen und therapeutische Ansatzpunkte identifizieren wollen, ist es naturgegeben sinnvoll, diese frühen Erkrankungsphasen zu untersuchen. Das ist wiederum schwierig, weil man die Erkrankung eben von außen nicht erkennen kann. Wir stehen also einem Prozess gegenüber, von dem wir nur die schweren Endstadien des Erkrankungsverlaufs vor uns haben und untersuchen können.“
3. Das Gehirn als komplexes System
„Dann geht es hier um eine Erkrankung, die die höchsten kognitiven Fähigkeiten betrifft, die das Gehirn leisten kann: Gedächtnis und Sprache. Wir wissen bis heute nicht, wie diese im gesunden Gehirn molekularbiologisch funktionieren – vor diesem Hintergrund wird deutlich, dass es umso schwieriger ist, eine Störung in seiner Ursachenkette und in seinen möglichen therapeutischen Angriffspunkten zu verstehen.“
4. Eine typisch menschliche Erkrankung
„Da eben speziell kognitive Fähigkeiten in Mitleidenschaft gezogen werden, ist Alzheimer eine Erkrankung, die nur den Menschen betrifft. Es ist nicht möglich, die Erkrankung mithilfe eines Tiermodells zu untersuchen – zumindest nicht in der Komplexität, wie sie beim Menschen auftritt. Man kann nur einzelne Hypothesen, aber nicht den Krankheitsverlauf untersuchen.“
5. Ein winziger Fehler
„Nach der Diagnose hat der Patient noch etwa eine Lebenserwartung von zehn Jahren. Der Gesamtprozess der Krankheit dauert jedoch sicher dreißig Jahre oder länger. Wenn man sich nun vorstellt, es gibt irgendeine Schädigung im Organismus in irgendeiner Zelle, die dreißig Jahre oder länger braucht, um zu dessen Untergang zu führen, dann muss diese sehr klein sein. Das zeigt auch, vor welcher Herausforderung wir in diesem Forschungsfeld eigentlich stehen: Wir suchen die sprichwörtliche Nadel im Heuhaufen.“
Spurensicherung früher ansetzen
Um die Erkrankung bereits in früheren Stadien zu erkennen und untersuchen zu können, wird deshalb verstärkt an frühen Diagnosemethoden geforscht. „Hier hat es in den vergangenen Jahren vermehrt vielversprechende Ergebnisse gegeben“, berichtet Professor Arendt. So wurden in den letzten 15 Jahren spezifische Biomarker für die Alzheimer-Erkrankung entwickelt, also Moleküle, die eine bestimmte Veränderung im Körper anzeigen, die mit Alzheimer in Verbindung gebracht werden – zum Beispiel die Aβ-Plaques im Gehirn. Mithilfe radioaktiv markierter Moleküle (zum Beispiel Fluor-18), sogenannten PET-Liganden, die an Aβ binden, kann man die Ablagerungen an lebenden Patienten mithilfe von Positronenemissionstomographie (kurz PET) sichtbar machen.
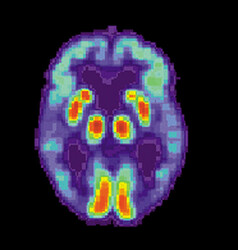
PET-Bild eines Alzheimer-Gehirns. Die roten Flächen zeigen die mit Plaques besetzten Bereiche an. Bild: US National Institute on Aging, Alzheimer's Disease Education and Referral Center, PET Alzheimer, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons
Auch im Bereich der Bluttests gibt es verschiedene Ansätze, um die Erkrankung anhand von Veränderungen in der Zusammensetzung des Blutes bereits Jahre, bevor erste Symptome auftreten, zu detektieren. Beispielsweise entwickeln Forscher der Ruhr-Universität Bochum einen Test, der das fehlerhaft gefaltete Aβ im Blut anzeigt. Professor Arendt hat mit seinem Team am Paul-Flechsig-Institut der Universität Leipzig einen anderen Ansatz erforscht: Sie fanden heraus, dass weiße Blutkörperchen von Alzheimer-Erkrankten anders auf die Stimulation mit bestimmten Stoffen reagieren als die nicht Erkrankter. Auf dieser Basis haben die Forscher einen Test entwickelt, den nun eine US-amerikanischen Biotechnologiefirma weiterentwickelt.
Einen weiteren Ansatzpunkt bietet das Auge: Dass bei Alzheimer-Patienten eine verringerte Netzhautdurchblutung und Dichte der Blutgefäße vorliegt, ist schon länger bekannt. Auch auf dieser Basis werden derzeit Tests für die Früherkennung entwickelt, indem man die Kapillaren am hinteren Auge oder die Netzhaut als Biomarker nutzt.
Auf der Jagd nach dem Täter
Auch die Wirkstoffforschung lässt sich durch Rückschläge nicht beirren. Zahlreiche Forschungseinrichtungen und Pharmaunternehmen sind den Ursachen auf der Spur. Rund 80 klinische Studien der fortgeschrittenen Phase III laufen laut Studienregister der EU derzeit in Europa – über die Hälfte davon in Deutschland.
Hier geht es zum zweiten Teil des Beitrags über die Alzheimer-Erkrankung: https://faszinationchemie.de/wissen-und-fakten/news/die-alzheimer-erkrankung-ein-raetselhafter-kriminalfall-teil-ii/


Kommentare
Keine Kommentare gefunden!