Chrom: mal essentiell, mal toxisch, aber auf alle Fälle bunt

Chrom lässt Wasserhähne glänzen und gibt Weinflaschen die typisch grüne Farbe. Wie so oft bei Metallen hängt es von der Oxidationszahl ab, ob das Element toxisch oder ein wichtiges Spurenelement ist.
Das Element Chrom ist ein Übergangsmetall der 6. Nebengruppe und trägt die Ordnungszahl 24. Der Name des beliebten Metalls leitet sich von „chroma“, dem griechischen Wort für Farbe ab. Und in der Tat: nomen est omen, denn Chrom ist in seinen Verbindungen so bunt wie kaum ein anders Element.

Abb. 1: Elementares Chrom (Foto:de:Benutzer:Tomihahndorf, Chrom 1, Wikimedia Commons, gemeinfrei)
Ein Schmetterling unter den Übergangsmetallen
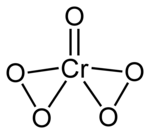
Abb 2.a: Chromperoxid (CrO(O2)2), “Chromschmetterling” (Formel: Benjah-bmm27, CrO5-2D, Wikimedia Commons, gemeinfrei)

Abb 2.b: Chromperoxid (CrO(O2)2) an der Grenzfläche zwischen organischer und wässriger Phase (Foto: Erinacaeus, Chromium(VI)-peroxide analysis, CC BY 3.0)
Typisch für die Übergangsmetalle ist auch, dass sie in vielen unterschiedlichen Oxidationsstufen vorkommen. Bei Chrom sind Verbindungen mit Cr(-II) bis Cr (+VI) bekannt. Die wichtigsten Oxidationsstufen sind +III und +VI, wobei sechswertige Chromverbindungen starke Oxidationsmittel sind.
Chrom kommt zusammen mit anderen Metallen in Legierungen und intermetallischen Phasen wie beispielsweise CrSb oder Cr2As vor. Mit Nichtmetallen bildet es Oxide, Sulfide und Halogenide. Zwei und dreiwertiges Chrom bilden farbenfrohe Komplexe. Und auch sechswertiges Chrom bildet auffällig bunt gefärbte Verbindungen: im Alkalischen das gelbe Chromat (CrO42-) und im Sauren das orange Dichromat (Cr2O72-), s. Abb. 4.a und 4.b unten.
Doch damit nicht genug – auch das intensiv blau leuchtende Chromperoxid (CrO(O2)2), bekannt als „Chromschmetterling“, ist eine Verbindung des Cr(VI). Als Nachweis für das Element dürfe das nur in Ether stabile Chromperoxid Studierenden der Chemie im ein oder anderen Analytik Praktikum schon begegnet sein. Wird die Probe mit verdünnter Salpetersäure und Wasserstoffperoxid vermischt und mit Ether überschichtet, bildet sich bei Vorhandensein von Chrom ein blauer Ring an der Grenzfläche.
Auch organische Chromverbindungen sind bekannt, allerdings sind sie instabil und in der Regel sehr reaktiv.
Vauquelin und Klaproth waren Chrom auf der Spur

Abb. 3: Louis-Nicolas Vauquelin, erster Hersteller elementaren Chroms (Unknown author, Louis-Nicolas Vauquelin (1763-1829), Wikimedia Commons, gemeinfrei)
Der französische Apotheker und Chemiker Louis-Nicolas Vauquelin entdeckte Chrom im Jahr 1797. Er analysierte Rotbleierz (Krokoit, PbCrO4) und hielt es zuerst für ein Bleimineral. Er schloss das Erz mit Säure auf und trennte Blei ab. Das verbleibende, damals noch unbekannte, Cr2O3 konnte er schließlich einige Monate später mit Holzkohle zu metallischem Chrom reduzieren.
Wie so oft bei der Entdeckung neuer Elemente, war Vauquelin nicht der Einzige. Fast zeitgleich beschäftigte sich auch der deutsche Chemiker Martin Heinrich Klaproth damit, Chrom zu isolieren. Vauquelin publizierte seine Entdeckung jedoch schneller und auch er war es, der Chrom seinen Namen gab.
Reduktion aus Erzen
Reines Chrom wurde 1894 erstmals aluminothermisch von Hans Goldschmidt gewonnen. Bei der einfacheren Reduktion mit Kohlenstoff, wie Vauquelin sie zuvor durchgeführt hatte, entsteht nämlich neben Chrom auch Chromcarbid. Auch heute noch ist die aluminothermische Reduktion für reines Chrom die Methode der Wahl. Zur Verchromung von Oberflächen reduziert man elektrolytisch aus Chrom(III)-Salzlösungen und zur Gewinnung von Ferrochrom, einer Chrom-Eisen-Legierung, reduziert man Chromeisenstein (Chromit, FeCr2O4) mit Kohle.
Chrom kommt in einem Anteil von 2-60 mg pro kg Erdgestein vor und steht auf Platz 21 der natürlich vorkommenden Elemente. Es ist damit häufiger als Kupfer und Zink. Die häufigsten Erze sind Chromeisenstein, Rotbleierz (Krokoit PbCrO4) und Chromocker (Cr2O3). Elementar kommt Chrom nur selten vor.
2021 wurden weltweit 35 Millionen Tonnen Chrom gefördert. Das Metall macht Legierungen härter und widerstandsfähiger gegen chemische Einflüsse und hohe Temperaturen. Bekannt ist vor allem das Ferrochrom mit etwa 60 Prozent Chromanteil. Auch zum Verchromen von Oberflächen wird das Metall gerne verwendet. So schützt man Stahl, Gusseisen oder Kupfer vor Verschleiß und lässt sogar Kunststoff oder Aluminium durch eine dünne Chromschicht glänzen.
Mit Chrom(III)-Salzen, meist basischem Cr(OH)SO4, werden Tierhäute zu Leder gegerbt.
Farbenfrohe Chrom-Verbindungen

Abb. 4.a: Cr2O3: FK1954, Chromium(III)-oxide pigment, Wikimedia Commons, gemeinfrei)

Abb. 4.b: K2Cr2O7: Benjah-bmm27, Potassium-dichromate-sample, Wikimedia Commons, gemeinfrei)

Abb. 4.c: PbCrO4: FK1954, Lead chromate, CC0 1.0
Die Tabelle zeigt einige Chromverbindungen und ihre Farben. Obwohl Chromverbindungen das ganze Farbspektrum abdecken, gibt es nur wenige Verbindungen, die auch in Farbpigmenten verwendet werden.
| Cr(H2O)6(OCOCH3)3 | blauviolett |
| CrCl3 | rotviolett |
| Cr2(SO4)3, KCr(SO4)2 | violett |
| Cr(NO3)3 | schwach grün |
| Cr2O3 | „Kölner Brückengrün“ (Abb. 4.a) |
| CrPO4 | blaugrün |
| CrO2 | braun bis schwarz |
| CrO3 | dunkelrot |
| PbCrO4 | „Chromgelb“ (Abb. 4.c) |
| Na2CrO4 | gelb |
| KCr2O7 | orange (Abb. 4b) |
Früher wichtige Malerfarbe: Chromgelb
Vincent van Gogh verwendete PbCrO4, bekannt als „Chromgelb“, für seine berühmten Sonnenblumen, eine Serie von insgesamt sieben Gemälden. Wie intensiv gelb sie zu seinen Lebzeiten leuchteten, können wir heute jedoch nicht mehr genau sagen, denn Chromgelb ist nicht sehr lichtbeständig. Deshalb wird es heute in der Malerei auch nicht mehr verwendet.
Chromoxidgrün (Cr2O3) benutzt man seit Jahrhunderten, um Glas oder Emaille einzufärben. Metallkomplexfarbstoffe, wie zum Beispiel Acid Blue 193, enthalten Chrom als Zentralteilchen. Sie finden Einsatz als Industriefarbstoffe.

Abb. 5: “12 Sonnenblumen”, Vincent van Gogh (Vincent van Gogh artist QS:P170,Q5582, Van Gogh Twelve Sunflowers, Wikimedia Commons, gemeinfrei)
In Spuren physiologisch wichtig
Chrom(III) gilt als essentielles Spurenelement. Es ist Bestandteil des Glucosetoleranzfaktors (GFT), einer Komplexverbindung aus Nikotinsäure, Niacin und drei essenziellen Aminosäuren. GFT senkt den Blutzuckerspiegel. Chrom soll auch das Auftreten von Arteriosklerose, einer Gefäßerkrankung, bei der Ablagerungen die Blutgefäße verengen, verzögern.
Als Nahrungsergänzungsmittel ist Chrom dennoch nicht zu empfehlen. Die Europäische Lebensmittelsicherheitsagentur (EFSA) empfiehlt nämlich, die maximale Tagesdosis von 60 µg Chrom nicht zu überschreiten. Typische Präparate zur Nahrungsergänzung enthalten jedoch 200 – 500 µg des Metalls. Zudem deckt eine ausgewogene Ernährung den Bedarf an Chrom problemlos. Schon Grundnahrungsmittel wie Brot, Kartoffeln, Milch und Fleisch enthalten zwischen 1 und 10 µg Chrom je 100 g. Ein Chrommangel bei gesunden Menschen ist nicht bekannt.
Wie so oft: Die Oxidationsstufe macht das Gift
Während Chrom (III) also in geringen Dosen gesundheitsförderlich ist, ist Chrom(VI) toxisch, cancerogen und mutagen. Vergiftungen sind hauptsächlich als Berufskrankheiten aus Gerbereien oder Galvanisierbetrieben bekannt, denn im Alltag kommt man nicht mit größeren Mengen Chrom(VI) in Kontakt.
Eine Untersuchung aus dem amerikanischen Painesville (Ohio) zeigt: Das Risiko an Lungenkrebs zu versterben, ist für Arbeiter in Betrieben der Chromatproduktion deutlich erhöht. Als „Chromatgeschwür“ ist eine chronische Krankheit seit 1827 bekannt. Sie trat im schottischen Glasgow erstmals auf. Typisches Kennzeichen der Vergiftung sind juckende Geschwüre, die erst nach Monaten auftreten. Sie sind eine Folge der ätzenden Wirkung der Chromate.
Cr(III) ist schlechter in wässrigen Medien löslich als Cr(VI) und wird in geringerem Maße resorbiert. Es weist lediglich eine geringe Toxizität auf und ist nicht als krebserregend eingestuft. Sehr hohe Konzentrationen an Chrom(III)sulfat können allerdings zu Herzversagen führen. Auch andere Cr(III)-Verbindungen können Haut, Leber und Nieren schädigen. Akute und chronische Vergiftungsfälle sind nur sehr vereinzelt mit Cr(III)-Verbindungen, jedoch in hohem Maße mit Cr(VI)-Verbindungen dokumentiert.
Die Europäische Chemikalienagentur regelt den Einsatz von Chrom (VI)

Abb. 6: Erin Brokovich im Jahr 2016 (Gage Skidmore from Peoria, AZ, United States of America, Erin Brockovich (30109127682), CC BY-SA 2.0)
Durch ungeklärte Industrieabwässer kann toxisches Chrom (VI) in die Umwelt gelangen. Dies geschah zum Beispiel in Hinkley (Kalifornien) in den 1950er und 1960er Jahren. Das Unternehmen Fall Pacific Gas & Electric hatte über Jahre hinweg Chrom(VI)-Verbindungen ins Grundwasser geleitet. Die Rechtsanwaltsgehilfin Erin Brokovich (Abb. 6) deckte dies in den 1990er Jahren auf. Der Fall wurde im Jahr 2000 mit Julia Roberts in der Hauptrolle verfilmt. Julia Roberts erhielt für die Darstellung von Erin Brockowich den Oscar als beste Hauptdarstellerin.
Cr(VI) kann Allergien auslösen
Zwar reichert sich Chrom nicht in Pflanzen an, kann aber trotzdem ins Trinkwasser gelangen. Die Europäische Chemikalienagentur (ECHA) hat Chrom (VI) 2011 in die REACH-Verordnung mit aufgenommen. Nach einer Übergangsfrist dürfen in Europa seit 2017 nur noch solche Unternehmen Chrom (VI) verarbeiten, die eine Zulassung bei der ECHA eingebracht haben. Diese Verordnung gilt auch für Zulieferer. Verboten ist Chrom (VI) damit aber nicht. Jedoch ist geregelt, wer toxische Chromverbindungen verwenden darf.
Eine Gefahr für Umweltbelastungen sollte Chrom (VI) in Europa demnach nicht mehr darstellen. Auch Luftuntersuchungen zeigen: in Industriegebieten ist die Chrom-Konzentration zwar höher als in ländlichen Gegenden, aber immer noch weit unterhalb der technischen Richtkonzentration für Cr(VI) am Arbeitsplatz.
Dennoch können auch geringe Mengen an Chrom (VI) in Lederwaren bei manchen Menschen Allergien auslösen. Die mineralische Gerbung findet zwar mit Cr(III)-Salzen statt, doch durch unreine Chemikalien oder mangelhafte Arbeitsprozesse kann abhängig vom pH-Wert, der Temperatur und den Lichteinflüssen auch schon während des Gerbens eine Oxidation zu Cr(VI) stattfinden. Dieses kann dann schon bei einem Gehalt von wenigen Milligramm pro Kilogramm Leder Allergien auslösen.
Seit 2015 gilt deshalb ein Höchstwert an Cr(VI) von 3 mg pro kg Leder, der aber Untersuchungen unterschiedlicher Landesbehörden für Verbraucherschutz (genaue Bezeichnung variiert je nach Bundesland) zufolge auch manchmal überschritten wird.

Quellen
Hollemann, A. F., Wiberg, E., Wiberg, N., Lehrbuch der Anorganischen Chemie, Auflage 102, Walter de Gruyter, Berlin 2007.
Meissner, W., Beitrag zur Geschichte des Chrom, Annalen der Physik 60.12: 366-394, 1818.
http://www.inchem.org/documents/ehc/ehc/ehc61.htm
http://toxcenter.org/stoff-infos/c/chrom.pdf
https://www.deutsche-apotheker-zeitung.de/daz-az/2008/daz-37-2008/chrom-iii-und-chrom-sex-vi
https://de.statista.com/statistik/daten/studie/1127359/umfrage/foerderung-von-chrom-weltweit/
https://www.deutsche-apotheker-zeitung.de/daz-az/2006/daz-11-2006/uid-15588
https://www.klartext-nahrungsergaenzung.de/faq/projekt-klartext-nem/chrom-als-chrompicolinat-24990
https://www.efsa.europa.eu/de/efsajournal/pub/3845
International Agency for Research on Cancer. Chromium, Nickel and Welding. IARC Monographs, 49:49-256, 1990.
Assem L. und Zhu H., Chromium – Toxicological Overview, HPA Center for Radiation, Version 1:1-14, 2007.
Cerulli J. et al., Chromium picolinate toxicity, Ann Pharmacother, 32(4):428-431, 1998.
Kelly, W. F. et al., Cutaneous absorption of trivalent chromium: tissue levels and treatment by exchange transfusion. British Journal of Medicine 39:397-400, 1982.
https://www.arge-ot.at/wp-content/uploads/2021/02/2021-02-26-Information-Chrom-VI-AOT.pdf
Bundesanstalt für Arbeitsschutz und Arbeitsmedizin, Ausschuss für Gefahrstoffe (AGS). Begründung zu Chrom VI in TRGS 910
https://www.lgl.bayern.de/produkte/bedarfsgegenstaende/bg_koerperkontakt/chrom_bg_koerperkontakt.htm

Kommentare
Keine Kommentare gefunden!