Brom, eines von zwei flüssigen Elementen

2019 – Jahr des Periodensystems
Bromhaltige Verbindungen sind seit sehr langer Zeit bekannt. In der Antike wurde Purpur (6,6‘-Dibromindigo) aus Purpurschnecken gewonnen. Die aufwendige Herstellung und stabile Farbe des Purpurs machte es zu einem Statussymbol, das selbst in der Bibel Erwähnung fand.[1] Das Tragen von Kleidern, die mit dem kostbaren Purpur gefärbt wurden, blieb dem Adel und dem Klerus vorbehalten. Diese Anwendung von Brom enthaltenden Verbindungen fand jedoch lange vor der Entdeckung des Elements statt. Denn dieses wurde als Erstes von dem 23-jährigen Franzosen Antoine-Jérôme Balard im Jahr 1826 aus Meerwasser dargestellt. Aufgrund seines Gestankes (griechisch brómos) erhielt Brom seinen Namen. Streng genommen war es aber Justus von Liebig, der Brom ein paar Jahre zuvor aus Salzsolen isolieren konnte, es aber für das Interhalogen Iodchlorid hielt. So sagte Liebig über sich selbst: „Seit dieser Zeit hat er keine Theorien mehr aufgestellt, wenn sie nicht durch unzweifelhafte Experimente unterstützt und bestätigt wurden; und ich kann vermelden, dass er daran nicht schlecht getan hat.“
Seine fälschliche Annahme, dass er Iodchlorid isoliert hätte, ist gewissermaßen auch verständlich, da sich dieses Interhalogen wie ein Halogen verhält und dessen physikalisch-chemische Eigenschaften zwischen denen von Chlor und Iod liegen, wo es auch im Periodensystem zu finden ist. Nichtsdestotrotz sind auch Interhalogenverbindungen, die Brom enthalten, bekannt. Brom ist als einziges nicht-metallisches Element unter Standardbedingungen flüssig und besitzt eine rotbraune Farbe (Abb. 1).

Brom kommt auf der Erde nicht elementar vor und wird daher seit seiner Entdeckung aus Salzsolen z. B. in Arkansas oder aus dem Toten Meer gewonnen. Die Konzentration an Bromid im Toten Meer beträgt ca. 5000 ppm und ist somit mehr als 800-fach höher als in der Erdhülle (ca. 6 ppm).[2] Die Hauptproduzenten von elementarem Brom sind die USA und Israel. Industriell wird die Salzsole z. B. durch Sonneneinstrahlung weiter eingeengt, und die darin enthaltenen Bromide werden im Anschluss mit elementarem Chlor zu Brom oxidiert. Das gewonnene Brom wird durch Einleitung von Wasserdampf von seinen Verunreinigungen getrennt, da Brom im Gegensatz zu den anderen Nebenprodukten eine geringere Löslichkeit in Wasser aufweist.
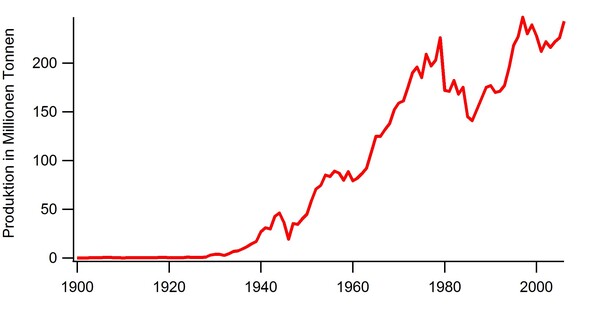
Abbildung 2 zeigt die jährliche Bromproduktion der USA von 1930 bis 2006.[3] Der enorme Anstieg bis zum Jahr 1980 ging einher mit der gestiegenen Nachfrage für Treibstoffe. Dort wurde 1,2-Dibromethan als Kraftstoffadditiv eingesetzt, um eine Abscheidung von elementarem Blei im Motorraum aus den bis dahin bleihaltigen Treibstoffen zu vermeiden. Durch gesetzliche Bestimmungen wurde die Verwendung von bleihaltigen Treibstoffen immer weiter eingegrenzt, was zu einem Einbruch der jährlichen Bromproduktion führte. Erst durch die Erschließung weiterer Anwendungsmöglichkeiten stieg die jährliche Produktion wieder deutlich an.
In den darauffolgenden Jahren entwickelten sich neue Anwendungsgebiete für bromhaltige Verbindungen. Hypobromige Säure wird z.B. als Alternative zur hypochlorigen Säure als Desinfektionsmittel in Schwimmbädern eingesetzt.[4] Die Säure ist ein starkes Oxidationsmittel und deren Salze, die Hypobromite, finden als Bleichmittel Anwendung in der Industrie.
Darüber hinaus waren Organobromverbindungen als Flammschutzmittel bis vor einigen Jahren noch von essentieller Bedeutung. In über 90 % der Elektrogeräte sind oder waren bromhaltige Flammschutzmittel enthalten, um die Entstehung eines Brandes bereits in den Anfängen zu ersticken. Die Einsatzgebiete als Brandschutzmittel sind dabei vielfältig. Ob in Kunststoffen, Textilien, Leiterplatten, Haushaltsgeräten oder in der Wärmedämmung im Bauwesen: Bromhaltige Verbindungen sind fast überall zu finden. Bekannte Beispiele für solche bromhaltigen Flammschutzmittel sind in Abbildung 3 gezeigt.[5] Seit 2008 ist diese Anwendung von Brom stark rückläufig [2], da die EU [6] und die Industrie selbst einen Ausstieg aus den bromhaltigen Flammschutzmitteln anstreben. Dieser Ausstieg wirkt sich entsprechend auf die weltweite Bromproduktion aus, so dass neue Anwendungsmöglichkeiten intensiv erforscht werden.
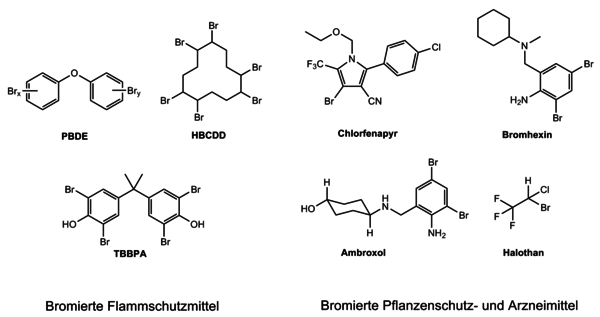
Abbildung 3: Bromhaltige Flammschutzmittel (S. Riedel, FU Berlin)
Daneben werden bromhaltige Verbindungen auch in der Schädlingsbekämpfung eingesetzt. So benutzt man das giftige, gasförmige Brommethan auf Erdbeerfeldern in Ausnahmefällen noch immer, obwohl seit 2005 die Verwendung von Brommethan durch das Montreal Abkommen untersagt ist.[7] Weitere bromhaltige Pflanzenschutzmittel sind Chlorfenapyr oder Bromuconazol, welches als Fungizid zugelassen ist.
Dass bromhaltige Verbindungen nicht immer giftig sein müssen, zeigt sich in der Medizin.[2] Als schleimlösendes Hustenmittel werden beispielsweise Bromhexin oder Ambroxol eingesetzt. Als Narkosemittel kommt Halothan zum Einsatz, eine Verbindung, die gleich drei Halogene enthält: Fluor, Chlor und Brom (Abb. 3).
Nicht nur bromhaltige Verbindungen finden vielfache Anwendung. Auch elementares Brom wird in der Industrie eingesetzt, z. B. in der Zink-Brom-Batterie, siehe Kasten. Die Komplexierung des Broms in der Zink-Brom-Batterie ist auf die Bildung von Polybromiden zurückzuführen. Deren systematische Untersuchung ist Gegenstand aktueller Forschung. Gerade in den letzten Jahren ist es gelungen durch neue Synthesestrategien zahlreiche neuartige Polybromide wie z. B. die Monoanionen [Br7]– [9], [Br9]– [10], [Br11]– [11] oder das Dianion [Br20]2– [12] mit sehr interessanten Eigenschaften darzustellen und näher zu charakterisieren. So zeigen diese z. B. extrem hohe Leitfähigkeiten oder können als Bromierungsreagenzien eingesetzt werden.[13]
Seit der Entdeckung von Brom sind inzwischen fast zwei Jahrhunderte vergangen, doch noch immer erschließen sich neue Anwendungsmöglichkeiten, so dass Brom und bromhaltige Verbindungen in unserem Alltag omnipräsent sind und weiterhin sein werden.
Zink-Brom-Batterie
Die sekundäre Batterie kann hier als Redox-Flow-Batterie (RFB) betrieben werden. Die Besonderheit der RFBs besteht darin, dass die gespeicherte Energie nicht von der Zellgröße abhängt, sondern durch die Größe der Elektrolyttanks bestimmt wird. Außerdem sind Energiedichte (Elektrolyt) und Leistungsdichte (Elektrodenfläche) unabhängig voneinander skalierbar. Der Aufbau einer RFB ist schematisch in Abb. 4 dargestellt.
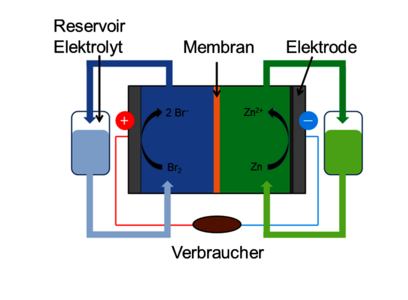
Es gibt zwei Tanks, die mit den Elektrolyten für die positive und negative Halbzelle gefüllt sind. Eine Pumpe sorgt für den Transport zu den Halbzellen, die wiederum durch eine Membran getrennt sind. Die Elektroden der Halbzellen bestehen im Falle der Zink-Brom-Batterie beide aus Kohlenstoffmaterialien. Der Anolyt besteht aus einer wässrigen Zinklösung aus der elementares Zink abgeschieden wird. Der Katholyt hingegen besteht aus einer Lösung aus organischen Ammoniumsalzen oder Aminen, die das bei der Oxidation von Bromid entstehende Brom komplexieren und somit den Dampfdruck verringern. Die erhöhte Leitfähigkeit resultiert in einem erniedrigten Zellwiderstand. Die Spannung solcher RFBs beträgt etwa 1,8 V [8].
[1] Bibel, Buch Ezechiel 27:7.
[2] M. Bertau, Industrielle Anorganische Chemie, Wiley-VCH, Weinheim, Germany, 2013.
[3] http://minerals.usgs.gov/minerals/pubs/historical-statistics/ [Zugriff: 25.07.2016].
[4] S. J. Judd, J. A. Jeffrey, Water Res. 1995, 29, 1203.
[5] https://www.efsa.europa.eu/de/topics/topic/bfr [Zugriff: 25.07.2016].
[6] Richtlinien 2003/11EG und 2002/95/EG.
[7] N. Jones, Nature 2009.
[8] J. Noack, N. Roznyatovskaya, T. Herr, P. Fischer, Angew. Chem. Int. Ed. 2015, 54, 9776; Angew. Chem. 2015, 127, 9912.
[9] X. Chen, M. A. Rickard, J. W. Hull, C. Zheng, A. Leugers, P. Simoncic, Inorg. Chem. 2010, 49, 8684.
[10] H. Haller, M. Ellwanger, A. Higelin, S. Riedel, Angew. Chem. Int. Ed. 2011, 50, 11528; Angew. Chem. 2011, 123, 11732.
[11] H. Haller, J. Schröder, S. Riedel, Angew. Chem. Int. Ed. 2013, 52, 4937; Angew. Chem. 2013, 125, 5037.
[12] M. Wolff, J. Meyer, C. Feldmann, Angew. Chem. Int. Ed. 2011, 50, 4970; Angew. Chem. 2011, 123, 5073.
[13] H. Haller, S. Riedel, Z. Anorg. Allg. Chem. 2014, 640, 1281.

Prof. Dr. Sebastian Riedel
Freie Universität Berlin, Institut für Chemie und Biochemie - Anorganische Chemie

M.Sc. Karsten Sonnenberg
Freie Universität Berlin, Institut für Chemie und Biochemie - Anorganische Chemie
Das Periodensystem ist ein faszinierendes Ordnungssystem, das die Natur den Elementen gegeben hat. Vor 150 Jahren wurde dieses System erstmals von Wissenschaftlern erkannt. Die Generalversammlung der Vereinten Nationen und die UNESCO haben das Jahr 2019 daher zum International Year of the Periodic Table of Chemical Elements, dem Internationalen Jahr des Periodensystems ausgerufen. Die Elemente des Periodensystems werden in loser Folge vorgestellt.
Dieser Beitrag wurde auf FaszinationChemie erstmalig veröffentlicht im April 2019

Kommentare
Claudia
am 29.04.2019kjs
am 09.05.2019Dr. Rudolf Stockerl
am 26.07.2019Frage: Wie stellt man Brom her?
Antwort: Wirft man Brombeeren auf die Erde, reagieren sie mit der Erde zu Erdbeeren und Brom wird nach folgender Reaktionsgleichung frei:
Brombeeren + Erde ---> Erdbeeren + Brom :-)
kjs (Redaktion)
am 29.07.2019