Arsen – Medikament und „Erbschaftspulver“
2019 – Jahr des Periodensystems
Arsen ist das 33. Element des Periodensystems, es steht in der 15. Gruppe, stellt ein schwereres Homologes des Stickstoffs bzw. des Phosphors dar und wird ausschließlich monoisotop als Nuklid 75As gefunden. Der Elementname kann auf die griechische Bezeichnung arseniós für das arsenhaltige Mineral Auripigment (As2S3) zurückgeführt werden und bedeutet so viel wie ‚männlich, furchtlos bzw. mutig‘.
Vorkommen, Entdeckung und Strukturen
Wenngleich Arsen selten gediegen als Scherbenkobalt bzw. Fliegenstein vorkommen kann, tritt es zumeist in sulfidischen Erzen wie Realgar (As4S4) und Auripigment (As2S3) auf. Darüber hinaus gibt es intermetallische Phasen wie Allemontit (AsSb) oder Arsenide wie Löllingit (FeAs2), wobei letztere mineralogisch zu den Sulfiden zählen. Bereits im Altertum waren einige arsenhaltige Mineralien wie das Auripigment und Arsenik (As2O3) bekannt. Arsen kann auch in Form von Arsenit- (AsIII) und Arsenationen (AsV) in Wässern gefunden werden. Dabei ist die Gesamtkonzentration meist sehr gering und unbedenklich. Jedoch werden örtlich auch verhältnismäßig hohe Konzentrationen gefunden (z.B. in Indien), wodurch auch Arsenvergiftungserscheinungen auftreten können. Als unbedenklich für Trinkwasser gilt eine maximale Konzentration von 0.01 ppm. Der erhöhte durchschnittliche Gehalt im Meerwasser von 0.024 ppm führt zur Anreicherung von Arsen in Schalen- und Krustentieren (bis zu 175 ppm). In anderen Lebensmitteln werden in aller Regel weitaus geringere Mengen gefunden (< 1 ppm).[1]
Die Entdeckung elementaren Arsens schreibt man dem Regensburger Bischof Albertus Magnus zu, der um 1250 Arsenik (As2O3) mit Kohle reduzierte. Es könnte jedoch schon vorher bekannt gewesen sein. Neben dem thermodynamisch favorisierten grauen Arsen (Asgr) sind noch die Modifikationen des gelben (As4) und des schwarzen Arsens (Asschw) bekannt (Abb 1).
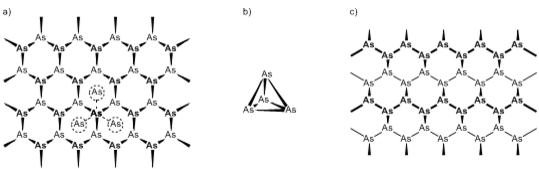
Asgr. bildet dicht gepackte, gewellte Doppelschichten aus As6-Sechsringen und ist isostrukturell zur Hochdruckmodifikation des schwarzen Phosphors. Durch den ausgesprochen kleinen Abstand der Schichten zueinander wird für jedes Arsenatom eine verzerrt oktaedrische Umgebung erhalten. Das metastabile schwarze Arsen ist wiederum isostrukturell zum schwarzen Phosphor, wobei der Aufbau dem des grauen Arsens ähnelt. Während Asschw. und Asgr. klassische Festkörper bilden, ist das gelbe Arsen molekular aus As4-Tetraedern aufgebaut (vgl. weißer Phosphor, P4). Es stellt bei Normalbedingungen die bei weitem instabilste Form dar und wandelt sich bei Raumtemperatur langsam zum grauen Arsen um. Die Einwirkung von Licht beschleunigt diesen Vorgang drastisch. Durch die Instabilität und die damit unvereinbare Lagerung wird As4 nur selten als Arsenquelle für chemische Umsetzungen verwendet, obgleich es die einzige lösliche Form darstellt.
Verwendung auf Grund der Giftigkeit
Dass Arsenverbindungen eine Wirkung auf Tier und Mensch besitzen, wurde bereits früh erkannt. So werden therapeutische Präparate von Realgar bzw. Auripigment in der traditionellen chinesischen Medizin seit mindestens 2400 Jahren verwendet, u.a. gegen Parasiten oder zur Behandlung von Neurodermitis. Auch aus dem antiken Griechenland und Rom sind entsprechende Berichte zur Therapie von Asthma und Hautkrankheiten bekannt. Der Arzt und Alchemist Paracelsus empfahl ebenfalls manche Arsenverbindungen zur Behandlung von Krankheiten. Er erkannte auch, dass es entscheidend auf die Dosierung der Arsenpräparate ankommt. Dies begründet sich auf der hohen Toxizität der meisten arsenhaltigen Substanzen. Während metallisches Arsen nicht giftig ist, sind dessen Verbindungen sehr giftig. Dabei wirken As(III)-Verbindungen generell stärker toxisch als As(V)-Derivate. Entsprechendes gilt auch für anorganische Materialien gegenüber stärker giftigen Organoarsenverbindungen. Bei einer medizinischen Anwendung muss immer die Toxizität gegenüber dem Krankheitserreger und dem Menschen abgewogen werden.
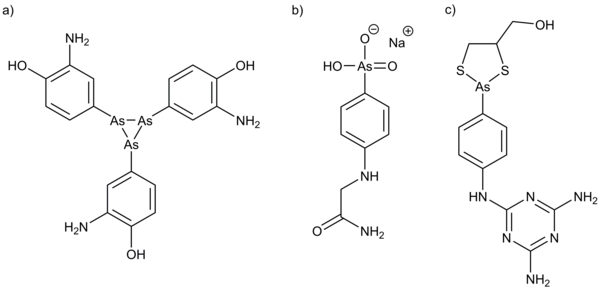
Ende des 18. Jahrhunderts entwickelte Thomas Fowler eine Tinktur (Fowlersche Lösung) aus Kaliumarsenit (KAsO2) und Lavendelwasser, welche ca. 150 Jahre als Allheilmittel verwendet wurde. Sie wurde z.B. gegen Fieber, Kopfschmerzen, Rheuma, Anämie, Asthma, Syphilis und Leukämie verwendet, um nur einige der behandelten Krankheiten zu nennen. Eines der bekanntesten arsenbasierten Medikamente ist Arsphenamin, welches 1910 von der Firma Hoechst unter dem Markennamen Salvarsan auf den Markt gebracht wurde (Abbildung 2). [2] Es wurde speziell zur Behandlung der Geschlechtskrankheit Syphilis entwickelt. Salvarsan und dessen weiterentwickelte Derivate wurden jedoch in den 1940er Jahren von Penicillin abgelöst. Gegen die parasitäre Schlafkrankheit (Afrikanische Trypanosomiasis) hat man in Afrika seit 1922 mit klinisch nachgewiesenem Erfolg Tryparsamid verwendet. Dieses wurde in den 1940er und 50er Jahren wiederum durch Melarsoprol, eine weitere Arsenverbindung, ersetzt. Trotz der hohen Toxizität und der starken, zum Teil tödlichen (5-10%), Nebenwirkungen, wird Melarsoprol aus Mangel an Alternativen auch heute noch zur Behandlung der Schlafkrankheit eingesetzt. Seit 2003 darf in den USA und einigen europäischen Ländern Trisenox® (Medikament mit Arsenik, As2O3) gegen Promyelozytenleukämie eingesetzt werden.[2b, 2c,3]
Die bereits erwähnte Giftigkeit der Arsenverbindungen wurde in der Vergangenheit nicht nur zur Behandlung von Krankheiten genutzt. Da sie grundsätzlich toxisch für alle Lebewesen sind, wurden und werden Arsenchemikalien als Herbizide und Pestizide eingesetzt. [4] Die Verwendung ist jedoch nicht unproblematisch, da das Arsen in das Grundwasser eingebracht werden kann und somit zu Vergiftungen an Mensch und Tier führt. In kleinerem Umfang kam Arsen auch gegen Schädlinge wie Fliegen und Ratten zum Einsatz.[2b,1]
In der breiten Bevölkerung ist Arsen jedoch nicht wegen seiner positiven Eigenschaften bekannt. Da Arsenverbindungen über Jahrhunderte hinweg als Mordgift eingesetzt wurden, hat sich das ins Gedächtnis der Menschheit eingebrannt. Hauptsächlich Arsenik wurde hierfür verwendet, da es wasserlöslich, geruch- und geschmacklos ist, leicht zu beschaffen war und erst nach einiger Zeit der Tod eintritt. Einer der ersten dokumentierten Arsenmorde geht auf das Jahr 55 n.Chr. zurück, wobei Nero seinen Rivalen Britannicus umgebracht haben soll, um seine Herrschaftsposition zu sichern.[2a] Insbesondere ab dem 17. Jahrhundert wurden viele Attentate durch Arsenvergiftungen durchgeführt, wobei einige sehr interessante Kriminalfälle die Folge waren. Dies brachte dem Arsenik den Beinamen ‚Erbschaftspulver‘ ein. Für eine ausführliche Zusammenstellung vgl. [1]. Durch die Entwicklung der Marsh‘en Probe als quantitativer Arsennachweis durch James Marsh im Jahre 1836 gingen die auf Arsen zurückzuführenden Morde schließlich zurück. Hiermit stand erstmals eine Methode zur Verfügung, mit welcher man Arsen im Gewebe mit hoher Genauigkeit nachweisen und somit auch die Mörder überführen konnte.
Kurioses
Eine weitere illegale Verwendung von Arsenpräparaten erfolgte in der Vergangenheit bei der sogenannten Roßtäuscherei. [5] Hier sollte die Einnahme zu einem schönen, glänzenden Fell führen. Außerdem kam es zur Appetitsteigerung der Pferde, wodurch sie mehr fraßen und somit kurz vor dem Verkauf gesünder und wohl genährt erschienen.
In der österreichischen Steiermark wurde vor allem im 19. Jahrhundert Arsenik von der Bevölkerung verspeist, um das allgemeine Wohlbefinden, die Ausdauer und die Atmungsfähigkeit zu steigern.[1,2a,b] Dabei wurden zunächst kleine Portionen gegessen und mit der Zeit die Menge stark erhöht. Arsenikesser vertrugen somit eine ansonsten letale Dosis ohne nachweisbare Vergiftungserscheinungen. Entsprechende Berichte sind bis Mitte des vorigen Jahrhunderts bekannt. Darüber hinaus sollen Prostituierte Fowlersche Lösung getrunken und aufgetragen haben, um einen gesunden Teint und rosige Wangen zu bekommen.
Arsen in der Elektroindustrie
Neben der oben beschriebenen Verwendung in Arzneimitteln und Pestiziden wurde und wird Arsen in starkem Umfang für technische Anwendungen eingesetzt. So findet man Arsen als Bestandteil in verschiedenen Legierungen. In Bleilegierungen wird heutzutage Arsen noch häufig gefunden, da es die Fließeigenschaften verbessert und das Material härter und korrosionsbeständiger ist. Dies ist sehr wichtig bei der Herstellung von bleibasierten Batterien und Akkumulatoren, aber auch für Bleimunition. [6]
Eine der wohl wichtigsten Anwendungen findet das Arsen jedoch in der Halbleiterindustrie. Durch die n-Dotierung von Gruppe 14 Halbleitermaterialien (vor allem Silizium) mit Atomen der 15. Gruppe (P, As, Sb) werden gezielt die Eigenschaften eingestellt, vor allem die elektrische Leitfähigkeit. Erst dadurch (zusammen mit p-Dotierung) sind Bauelemente wie Dioden, Computerchips und LEDs möglich. In größeren Mengen wird Arsen bei der Produktion von III-V-Halbleitern benötigt, da es hier in stöchiometrischer Menge und nicht nur als Dotierungsbestandteil (ppm-Bereich) benötigt wird. III-V-Halbleiter besitzen den Vorteil, dass sie oft eine bestimmte Bandlücke besitzen und somit für Leuchtdioden besser geeignet sind. Eben dies gilt für GaAs, wodurch es in LEDs und Lasern häufig zum Einsatz kommt.
Aktuelle Forschung
Arsen wird durch vielfältige Art in die Umwelt gebracht und verschmutzt so in weiten Teilen der Welt das Grund- und Trinkwasser. Zu den vom Menschen verursachten Quellen zählen u.a. der Bergbau und die Verhüttung, der Einsatz arsenhaltiger Futtermittel [7] und Pestizide, aber auch dessen Verwendung in der Glas- und Elektroindustrie. Vulkanismus und Auswaschung von Arsenmineralien sind als natürliche Gründe für örtliche Arsenkontaminationen zu nennen. Diese Problematik steht aktuell im Fokus der Forschung, zum einen, um Arsen besser nachweisen zu können, und zum anderen, um es aus dem Trinkwasser abzutrennen bzw. präventiv dagegen vorzugehen. [8]
Auch grundlagenchemische Sachverhalte sind stets von Interesse. So wurde die molekulare Tetraeder-Struktur von gelbem Arsen (As4) schon früh in der Gasphase aufgeklärt. [9] Es fehlten jedoch entsprechende kristallographische Daten, da sich gelbes Arsen im Festkörper zu grauem Arsen zersetzt. Unserer Arbeitsgruppe gelang es vor kurzem, As4-Tetraeder in einem sphärischen Molekülkäfig bzw. in einer Polymermatrix einzuschließen, dies zu kristallisieren und röntgenographisch am Einkristall zu untersuchen. [10] Zusätzlich konnten in den letzten Jahren auch Koordinationsverbindungen von gelbem Arsen isoliert werden, die durch Öffnen einer As-As Kante ein Tetraarsabicyclo[1.1.0]butan-Gerüst („Butterfly“) bilden [11] (Abb. 3, A) oder einen intakten As4-Tetraeder terminal koordinieren. [12] (Abb. 3, B). Ebenfalls konnte durch die Aktivierung von gelbem Arsen mit dem Silylen [PhC(NtBu)2SiN(SiMe3)2] die neuartige As10-Käfigverbindung [(PhC(NtBu)2SiN(SiMe3)2)3As10] (C) erhalten werden. [13]
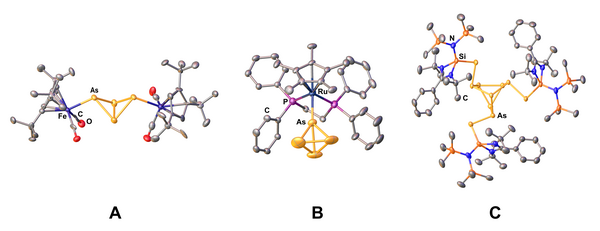
Abb. 3: Der As4-“Butterfly”-Komplex [{Cp’’’Fe(CO)2}2(µ,η1:1-As4)] (A), der Komplex [Cp*Ru(dppe)(η1-As4)]+[A]- (B) mit einem intakten As4-Tetraeder und die As10-Käfigverbindung [(PhC(NtBu)2SiN(SiMe3)2)3As10] (C). Wasserstoffatome, Lösungsmittelmoleküle und Anion (im Falle von B) sind aus Gründen der Übersichtlichkeit nicht abgebildet.([11], [12], [13])
Eine Gruppe von Forschern unter Leitung der NASA untersuchten extremophile Bakterien (GFAJ-1; Halomonadaceae) aus dem Mono Lake in Kalifornien, USA. Auf Grund der erhaltenen Ergebnisse haben sie auf den Einbau von Arsenat (AsO43-) anstelle von Phosphaten in Biomoleküle geschlossen, vor allem in die DNS.[14] Dies zog die Aufmerksamkeit der Bevölkerung weit über wissenschaftliche Kreise hinaus an sich. Jedoch konnte bereits ein Jahr später eine andere Arbeitsgruppe diese Theorie durch zahlreiche Untersuchungen widerlegen.[15]
[1] G. Süss-Fink, Chem. Unserer Zeit 2012, 46, 100-109.
[2] a) D. M. Jolliffe, J. Roy. Soc. Med. 1993, 86, 287-289. b) R. Bentley, T. Chasteen, Chem. Educator 2002, 7, 51-60. c) S. Gibaud, G. Jaouen, Top. Organomet. Chem. 2010, 32, 1-20.
[3] S.-J. Chen, G.-B. Zhou, X.-W. Zhang, J.-H. Mao, H. de Thé, Z. Chen, Blood 2011, 117, 6425-6437.
[4] a) M. F. Hughes, B. D. Beck, Y. Chen, A. S. Lewis, D. J. Thomas, Toxicol. Sci. 2011, 123, 305-332. b) B. K. Mandal, K. T. Suzuki, Talanta 2002, 58, 201-235.
[5] a) A. Mortgens, Vol. 85, Bernhard Friedrich Voigt, 1824. b) H. Meyer, Pferdeheilkunde 2002, 18, 377-389.
[6] S. C. Grund, K. Hanusch, H. U. Wolf, in Ullmann's Encyclopedia of Industrial Chemistry, Vol. A3, Wiley-VCH Verlag GmbH & Co. KGaA, 2000.
[7] In den USA sind arsenhaltige Futtermittelzusätze v.a. für Geflügel zugelassen: http://www.fda.gov/food/ingredientspackaginglabeling/foodadditivesingredients/ucm091048.htm
[8] a) J. H. T. Luong, E. Lam, K. B. Male, Analytical Methods 2014, 6, 6157-6169. b) D. van Halem, S. A. Bakker, G. L. Amy, J. C. van Dijk, Drink. Water Eng. Sci. 2009, 2, 29-34.
[9] L. R. Maxwell, S. B. Hendricks, V. M. Mosley, J. Chem. Phys. 1935, 3, 699-709.
[10] C. Schwarzmaier, A. Schindler, C. Heindl, S. Scheuermayer, E. V. Peresypkina, A. V. Virovets, M. Neumeier, R. Gschwind, M. Scheer, Angew. Chem., Int. Ed. 2013, 52, 10896-10899.
[11] C. Schwarzmaier, A. Y. Timoshkin, G. Balázs, M. Scheer, Angew. Chem., Int. Ed. 2014, 53, 9077-9081.
[12] C. Schwarzmaier, M. Sierka, M. Scheer, Angew. Chem., Int. Ed. 2013, 52, 858-861.
[13] A. E. Seitz, M. Eckhardt, S. S. Sen, A. Erlebacher, E. V. Peresypkina, H. W. Roesky, M. Sierka, M. Scheer, Angew. Chem. Int. Ed. 2017, 56, 6655-6659.
[14] F. Wolfe-Simon, J. S. Blum, T. R. Kulp, G. W. Gordon, S. E. Hoeft, J. Pett-Ridge, J. F. Stolz, S. M. Webb, P. K. Weber, P. C. W. Davies, A. D. Anbar, R. S. Oremland, Science 2011, 332, 1163-1166.
[15] M. L. Reaves, S. Sinha, J. D. Rabinowitz, L. Kruglyak, R. J. Redfield, Science 2012, 337, 470-473.

Prof. Dr. Manfred Scheer
Institute of Inorganic Chemistry, University of Regensburg

Dr. Sebastian Heinl
Institute of Inorganic Chemistry, University of Regensburg
Das Periodensystem ist ein faszinierendes Ordnungssystem, das die Natur den Elementen gegeben hat. Vor 150 Jahren wurde dieses System erstmals von Wissenschaftlern erkannt. Die Generalversammlung der Vereinten Nationen und die UNESCO haben das Jahr 2019 daher zum International Year of the Periodic Table of Chemical Elements, dem Internationalen Jahr des Periodensystems ausgerufen. Die Elemente des Periodensystems werden in loser Folge vorgestellt.
Foto Titelbild: Danielle Bonardelle/stock.adobe.com

Kommentare
Keine Kommentare gefunden!