Multivalente Makromoleküle gegen Viren und Bakterien
100 Jahre Makromolekulare Chemie
Funktionale Polymere werden in der Medizin bislang überwiegend für den Wirkstofftransport und als Biomaterialien in der Regeneration eingesetzt. Große Herausforderungen stellen jedoch auch die Abwehr von Viren und Bakterien dar. Hier bieten multivalente Makromoleküle einen neuartigen Ansatz, um vor Infektionskrankheiten zu schützen. [1]
Was sind multivalente Wechselwirkungen?
Multivalenz ist ein Schlüsselprinzip in der Natur zum Aufbau starker, zugleich aber auch reversibler chemischer Wechselwirkungen zwischen zwei Einheiten, z.B. Rezeptoren und Liganden, Viren und Zellen oder zwischen verschiedenen Grenzflächen (vgl. Abbildung 1). [2]

Abb.1: Bei multivalenten Wechselwirkung (links) wechselwirken mehrere kovalent verknüpfte Liganden (rot) gleicher oder ähnlicher Natur mit mehreren aneinander gebundenen Akzeptoren (blau). Prinzipien wie das Anhaften der Klette (Mitte) oder des davon inspirierten Klettverschlusses (rechts) lassen sich auch auf die molekulare Ebene übertragen. [2] Fotos: Copyright
Multivalente Bindungen basieren auf mehreren simultanen molekularen Erkennungs-prozessen und spielen beispielsweise in der Selbstorganisation von (Makro-)molekülen und bei biologischen Erkennungsprozessen sowie der Signaltransduktion in biologischen Systemen eine entscheidende Rolle. Multivalente Liganden, die im richtigen Abstand auf definierten Gerüsten präsentiert werden, können überproportionale Verstärkung von Bindungskonstanten an einen entsprechenden Akzeptor hervorrufen, so dass Gleichgewichte vollständig zugunsten des gebundenen Zustands verschoben werden. Ein eingängiges Beispiel aus dem täglichen Leben sind die Klette und der davon abgeleitete Klettverschluss (vgl. Abbildung 1).2
Durch Verschlaufung von multiplen Haken auf der einen und Ösen auf der anderen Seite kommt es hier durch die große Zahl schwacher Wechselwirkungen zu einer starken Verbindung beider Oberflächen, was z. B. ein Abscheren verhindert. Je größer die Klettfläche, desto stabiler die Wechselwirkung. Entscheidend ist hierbei aber auch die Reversibilität der Wechselwirkung, die durch sequenzielles Trennen der einzelnen Haken und Ösen erreicht werden kann. Diese wichtige Eigenschaft unterscheidet multivalente grundlegend von kovalenten Wechselwirkungen, die technisch einer permanenten Verklebung oder Verschraubung entsprächen.

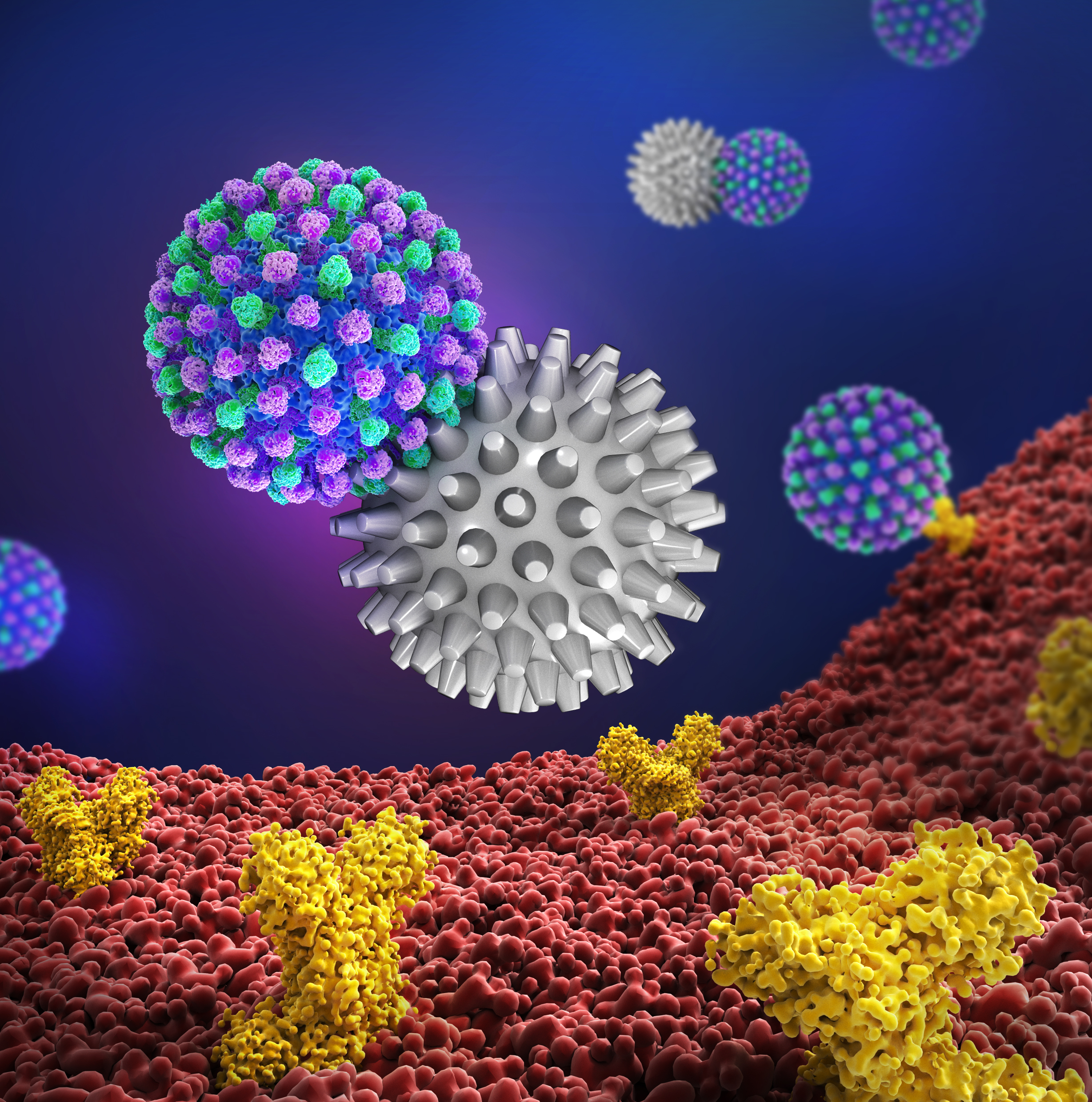
Abb. 2: Ein Virus (blau-grün) bindet an die Oberfläche der Wirtszelle (links). Klassische Wirkstoffe (rot) hemmen diese Wechselwirkung nicht (Mitte), multivalente Virus-Inhibitoren hingegen (grau) verhindern die Anbindung des Virus (rechts).[3] Foto: Copyright
Wie können multivalente Makromoleküle Virus-Infektionen verhindern?
Das Verhindern der Virenanhaftung an Zelloberflächen ist eine wichtige Strategie, um Virusinfektionen wie z. B. Influenza- und HIV-Infektionen zu hemmen. [1] Herkömmliche monovalente Wirkstoffe können die multiplen Adhäsionen des Virus an die Zelloberfläche nicht verhindern. Deshalb ist die Entwicklung von multivalenten Liganden (vgl. Abbildung 2), die an Membranproteine von Viren binden und somit deren Oberfläche „abschirmen“, ein wichtiges Forschungsziel im Sonderforschungsbereich (SFB) 765 an der Freien Universität Berlin. [4] Von grundlegender Bedeutung für die Abschirmung sind multivalente Glycan-Lectin-Wechselwirkungen. Lectine sind zuckerbindende Proteine mit definierter Glycanerkennungsdomäne auf der Oberfläche von Viren, Bakterien und Zellen. [5,6]
Influenza, besser bekannt als Grippe, ist eine der häufigsten Erkrankungen der Atemwege des Menschen. Sie wird durch Viren ausgelöst, die vor allem über die Schleimhäute der Lunge aufgenommen werden.
Im Falle des Influenza-A-Virus ist die Hämagglutinin (HA)-Sialinsäure (SA)-Wechselwirkung für die Virus-Bindung an die Zelle verantwortlich. Das Influenza-A-Virus dockt über spezifische HA-Oberflächenrezeptoren (Glycoproteine), an die Zuckerketten auf der Zelloberfläche, die am Ende häufig SA (5-N-Acetyl-neuraminsäure) tragen. Die HA-SA-Wechselwirkungen führen zu einer starken multivalenten Bindung (mit großer Bindungskonstante) des Sialinyl-Glycoproteins an das Hämagglutinin, woraufhin die Aufnahme des Virus in die Zelle ausgelöst wird und in dessen Folge es zur Infektion kommt (vgl. Abbildung 2). Im Gegensatz zu multivalenten Inhibitoren (klassische Wirkstoffe) gelingt es mit multivalente Gerüsten diese Virusinteraktion zu inhibieren. [6]
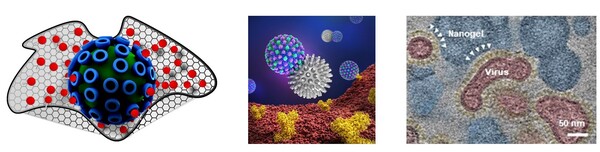
Im Rahmen des SFB 765 wurden multivalente Virus-Inhibitoren auf Basis makromolekularer Nanosysteme entwickelt, deren Oberflächen mit zahlreichen Sialinsäure-Liganden dekoriert sind.3-9 Diese Liganden binden nun mehrfach an die Rezeptoren des Virus und täuschen die Oberfläche der Lungengewebszellen vor (vgl. Abbildung 3). [7]
Dadurch wird das aktive Zentrum der SA blockiert und die Influenzaviren daran gehindert, mit ihren Rezeptoren an die Oberfläche der Wirtszelle zu binden und diese zu infizieren. Durch Variation der Geometrie (lineare und hyperverzweigte, und Nanogele), der Oberflächenfunktionalisierung und der Multiplizität der SA-Einheiten können diese makromolekularen Nanosysteme maßgeschneidert werden. Im Rahmen unserer Studien im SFB 765 haben wir uns dieses Maßschneidern zunutze gemacht und konnten die Influenzavirus-Aktivität sowohl in vitro als auch in vivo erfolgreich und effizient senken. Außerdem konnten wir zeigen, dass eine wirksame Hemmung nicht zwingend durch eine hohe Ligandendichte bewirkt wird. In einem Maus-Infektionsmodell konnten wir zeigen, dass lineare multivalente Makromoleküle, bei einer vergleichbaren Bindungsaffinität gegenüber dem Virus, eine höhere Hemmwirkung als ihre hyperverzweigten Analoga zeigen, was auf die höhere Gerüst-Flexibilität zurückzuführen ist. [6] Die daraus resultierende sterische Abschirmung verhindert eine Annährung des Virus mit der Zelle und somit eine Virus-Zell-Bindung. [4} Die Ergebnisse lassen sich auch auf die Adhäsion von Bakterien an Zelloberflächen anwenden. Zusammenfassend versprechen multivalente Makromoleküle einen therapeutischeren Ansatz, um Virus-Infektionen zu verhindern. [6]
Wie kann man sich eine Translation in die Anwendung vorstellen?
Für die Translation von neuen Wirkstoffen ist grundsätzlich ein langer Weg (ca. 5-10 Jahre) über präklinische Untersuchungen und klinische Studien zu absolvieren. Das hohe Potential dieser neuen multivalenten Virusinhibitoren auf Basis makromolekularer Strukturen wurde bereits in mehreren in vivo Studien belegt. [7] Allerdings muss die toxikologische Bewertung für die verschiedenen biofunktionalen Makromoleküle weiter geprüft werden, bevor hier der lange Weg in eine klinische Studie und ein potentieller Einsatz am Patienten möglich ist. Anders hingegen verhält es sich bei medizinischer Schutzausrüstung, hierfür besitzen die multivalenten Makromoleküle ein hohes Potential für die Adsorption von Viren und Bakterien auf der Oberfläche von Materialien. Eine Möglichkeit wäre, sie in den Vliesstoff einer Atemschutzmaske zu integrieren. Das bisher verwendete Material einer herkömmlichen OP-Maske ist ähnlich porös wie ein Kaffeefilter. Der Faserabstand ist zu groß, um Viren effizient zurückzuhalten. Würde ein entsprechender Vliesstoff mit solchen Virusbindern kombiniert werden, könnten die Atemschutzmasken sicherer werden. Eine Zulassung solcher funktionalen Textilmaterialien ist deutlich einfacher als bei neuen Wirkstoffen.
Autoren: Prof. Dr. Rainer Haag und Dr. Wiebke Fischer (Institut für Chemie und Biochemie, Freie Universität Berlin)
Redaktionelle Bearbeitung: Lisa Süssmuth, GDCh
Weitere Informationen zum Sonderforschungsbereich 765.
Titelbild Copyright: Lauster, D.; Glanz, M.; Bardua, M.; Ludwig, K.; Hellmund, M.; Hoffmann, U.; Hamann, A.; Böttcher, C.; Haag, R.; Hackenberger, C. P. R.; Herrmann, A., Multivalent Peptide–Nanoparticle Conjugates for Influenza-Virus Inhibition. Angew. Chem. Int. Ed. 2017,56 (21), 5931-5936.
Literatur
Haag, R.; Kratz, F., Polymer therapeutics: concepts and applications. Angew Chem Int Ed Engl 2006, 45 (8), 1198-215, bzw. Polymere Therapeutika: Konzepte und Anwendungen, Angew. Chem. 2006, 118 (8), 1218-37.
Fasting, C.; Schalley, C. A.; Weber, M.; Seitz, O.; Hecht, S.; Koksch, B.; Dernedde, J.; Graf, C.; Knapp, E. W.; Haag, R., Multivalency as a chemical organization and action principle. Angew Chem Int Ed Engl 2012, 51 (42), 10472-98, bzw. Multi
Bhatia, S.; Camacho, L. C.; Haag, R., Pathogen Inhibition by Multivalent Ligand Architectures. J. Am. Chem. Soc. 2016, 138 (28), 8654-8666.
Bhatia, S.; Ziem, B.; Haag, R., Blocking Pathogens by Multivalent Inhibitors. In Multivalency: Concepts, Research & Applications, Huskens, J.; Prins, L. J.; Haag, R.; Ravoo, B. J., Eds. John Wiley & Sons Ltd. : 2017; pp 205-228.
Bhatia, S.; Cuellar-Camacho, J. L.; Hilsche, M.; Nie, C.; Parshad, B.; Ludwig, K.; Lauster, D.; Sharma, A.; Böttcher, C.; Herrmann, A.; Haag, R., Sialylated nanogels for influenza A virus inhibition: ligand presentation and flexibility matte
Bhatia, S.; Lauster, D.; Bardua, M.; Ludwig, K.; Angioletti-Uberti, S.; Popp, N.; Hoffmann, U.; Paulus, F.; Budt, M.; Stadtmüller, M.; Wolff, T.; Hamann, A.; Böttcher, C.; Herrmann, A.; Haag, R., Linear polysialoside outperforms dendrit
Nie, C.; Stadtmüller, M.; Yang, H.; Xia, Y.; Wolff, T.; Cheng, C.; Haag, R.; Spiky nanostructures with geometry-matching topography for virus inhibition, Nano Letters, 2020, in press DOI 10.1021/acs.nanolett.0c01723
Lauster, D.; Glanz, M.; Bardua, M.; Ludwig, K.; Hellmund, M.; Hoffmann, U.; Hamann, A.; Böttcher, C.; Haag, R.; Hackenberger, C. P. R.; Herrmann, A., Multivalent Peptide–Nanoparticle Conjugates for Influenza-Virus Inhibition. Angew. Chem.
Donskyi, I. S.; Azab, W.; Cuellar-Camacho, J. L.; Guday, G.; Lippitz, A.; Unger, W. E. S.; Osterrieder, K.; Adeli, M.; Haag, R., Functionalized nanographene sheets with high antiviral activity through synergistic electrostatic and hydrophobic i

Kommentare
Keine Kommentare gefunden!