Mechanochemie: Bis die Kette bricht...

100 Jahre Makromolekulare Chemie
Mechanische Einflüsse können die Eigenschaften von Molekülen verändern, zum Beispiel führen sie zur Depolymerisation von Polymeren. Man spricht dann von mechanochemischer Aktivierung. Diese unerwünschten Nebeneffekte nutzt die Forschung, um unter anderem Katalysatoren zu aktivieren oder zu veranschaulichen, dass ein Material unter Belastung steht.
Einfluss mechanischer Größen
Chemische Reaktionen können durch unterschiedliche externe Einflüsse aktiviert werden. Am häufigsten geschieht dies durch Temperatur: So kann Wärme (Erhitzen) eine chemische Reaktion auslösen. Auch Licht einer bestimmten Wellenlänge initiiert bestimmte Reaktionen.
Zudem beeinflussen mechanische Belastungen chemische Reaktionen – insbesondere Reaktionen, die Polymere betreffen. Im Gegensatz zu kleinen organischen Molekülen aktivieren mechanische Kräfte kovalente Bindungen. Dieses Phänomen beobachtete bereits Hermann Staudinger, Begründer der Makromolekularen Chemie. [1] Er stellte fest, dass Cellulose beim Vermahlen teilweise depolymerisiert und sich dabei die Molmasse ändert. Dies spielt zum Beispiel bei der mechanischen Verarbeitung (z.B. Extrusion, Vermahlen, Recycling) von Polymeren eine Rolle. Denn ändert sich die Molmasse, tun dies auch die Eigenschaften. Interessanterweise brechen Makromoleküle in Lösung bei entsprechender mechanischer Belastung meist in bzw. nahe der Mitte.
In den letzten Jahren ist die Mechanochemie als neues Forschungsfeld entstanden. Sie nutzt die mechanochemische Aktivierung von Bindungen in Polymeren gezielt für diverse Anwendungen.
Anwendungen als Sensor
Um eine mechanische Belastung sichtbar zu machen, bietet sich die mechanochemische Aktivierung von speziellen Bindungen im Polymer an. Belastet eine bestimmte Kraft das Polymer, wird eine Reaktion ausgelöst, bei der sich die Farbe des Materials ändert (Mechanophor). Hierdurch kann man die Kraft lokal visualisieren und der Anwender kann direkt erkennen, dass das Material unter Belastung steht.
Ein Beispiel ist die Isomerisation von Spiropyran. [2] Unter Belastung ändert sich hier die Farbe des Materials von gelb zu einem intensiven Rot. Diese Farbveränderung ist reversibel: Bestrahlt man die Verbindung mit Licht, wandelt sich die offene rote Form wieder in die gelbe Spiroform um. So kann das Sensormaterial erneut verwendet werden.
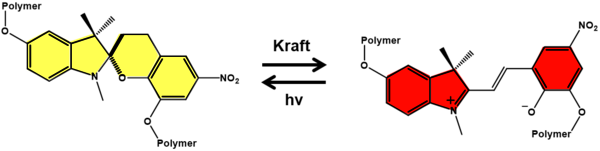
Schematische Darstellung der Isomerisierung von Polymeren mit Spiropyran durch mechanische Belastung. Wirkt eine Kraft auf die Verbindung ein, ändert sich die Farbe von Gelb zu Rot. Diese Farbänderung ist durch Licht reversibel. © Stefan Zechel, Martin D. Hager
Auch beim Diels-Alder-System, ausgehend von Maleinimid und Anthracen, kann man eine mechanochemische Reaktion beobachten: Die Diels-Alder-Einheit wird dabei gespalten (retro-Diels-Alder-Reaktion) und fluoreszierendes Anthracen wird freigesetzt. So zeigt die Fluoreszenz, das Leuchten bei Bestrahlung mit UV-Licht, die Kraft an. [3]
Anwendungen in der Katalyse
Auch die Katalyse nutzt die mechanochemische Aktivierung. Dabei werden Katalysatoren, in der Regel Metallkomplexe, in ein Polymer integriert. Wird dieses belastet, erfolgt eine Dekomplexierung, d.h. ein Ligand wird vom Metallkomplex abgespalten. Dies führt schließlich zu einer offenen Bindungsstelle am Metallzentrum und der Katalysator wird aktiviert. Diese Vorgehensweise hat den Vorteil, dass der Katalysator erst dann aktiv und reaktiv ist, wenn er benötigt wird. Damit halten sich die Materialien länger und Nebenreaktionen können vermieden werden. [4]
Polymere haben sich hierfür als besonders vorteilhaft erwiesen, da die Kraft gezielt auf den Katalysator übertragen wird. Zusätzlich schützt die Polymermatrix den Katalysator, wodurch eine längere Nutzung ermöglicht wird.
Typische Metallkomplexe sind Silber(I) und Kupfer(I)-Carben-Katalysatoren. [5, 6] Die kraftinduzierte Katalyse ermöglicht zum Beispiel Ringöffnungs-Metathese-Polymerisationen (ROMP) oder Azid-Alkin-Click-Reaktionen.

Typische Metallkomplexe, die für die mechanochemische Aktivierung genutzt werden. © Stefan Zechel, Martin D. Hager
Autoren: Dr. Stefan Zechel und Dr. Martin D. Hager (Friedrich-Schiller-Universität Jena)
Redaktionelle Bearbeitung: Lisa Süssmuth, GDCh
[1] H. Staudinger, E. Dreher, Ber. Dtsch. Chem. Ges. 1936, 69, 1091-1098.
[2] D. A. Davis, A. Hamilton, J. Yang, L. D. Cremar, D. Van Gough, S. L. Potisek, M. T. Ong, P. V. Braun, T. J. Martinez, S. R. White, J. S. Moore, N. R. Sottos, Nature 2009, 459, 68-72.
[3] D. Yildiz, C. Baumann, A. Mikosch, A. J. C. Kuehne, A. Herrmann, R. Göstl, Angew. Chem. Int. Ed. 2019, 58, 12919-12923.
[4] J. Li, C. Nagamani, J. S. Moore, Acc. Chem. Res. 2015, 48, 2181-2190.
[5] A. Piermattei, S. Karthikeyan, R. P. Sijbesma, Nat. Chem. 2009, 1, 133-137.
[6] P. Michael, W. H. Binder, Angew. Chem. Int. Ed. 2015, 54, 13918-13922.

Kommentare
Keine Kommentare gefunden!