„Gib Gummi!“ - Teil I

100 Jahre Makromolekulare Chemie
Jeder weiß, dass Reifen aus Gummi sind, aber warum? Und welche Gummis?
In einem so komplexen Bauteil wie einen Reifen hat „Gummi“ mehr als eine Funktion. Um dies dies auch nur im Ansatz zu erklären, braucht es zwei Beiträge. Und natürlich hat es mit der molekularen Struktur des Werkstoffs zu tun!
Was ist „Gummi“?
Gummi, in unverarbeiteter Form auch Kautschuk genannt, gehört zur Polymerklasse der Elastomere. Solche Polymere sind bei Raumtemperatur extrem elastisch und können auf mehrere hundert Prozent gedehnt werden.
Elastomere sind dadurch elastisch, dass ihre Ketten und Kettensegmente Platz haben, sich bewegen zu können. So kann ein Kautschukstück sich unter Kraftanwendung deformieren, indem sich die Ketten der neuen Form anpassen und strecken. Wird die Kraft zur Deformation zurückgenommen, verknäueln sich die Ketten wieder, angetrieben durch Entropie, und das Kautschukstück schnellt zurück in seine ursprüngliche Form.
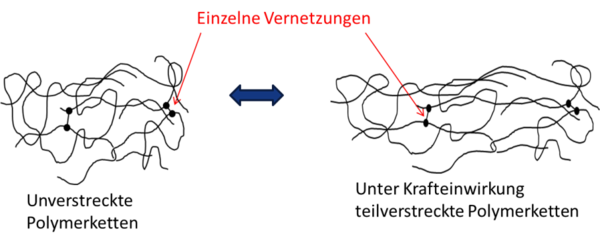
Schematische Darstellung unverstreckter und verstreckter Polymerketten © Annette Lechtenboehmer
Wenige Vernetzungspunkte – Bindungen zwischen einigen wenigen Monomeren verschiedener Ketten – verhindern ein Gleiten der Ketten gegeneinander. Die Kettensegmente bleiben aber beweglich. Diese Art der Elastizität nennt man „entropie-elastisch“; sie erlaubt große Deformationen. Andere, kristalline Stoffe sind „energie-elastisch“: durch eine äußere Kraft werden die Moleküle aus ihrer Gleichgewichtsposition, der der niedrigsten Energie, gelenkt. Sobald die äußere Kraft nicht mehr einwirkt, nehmen sie ihre ursprüngliche Position wieder ein. Diese Deformation kann nur wenige Prozent ausmachen; bei größeren Deformationen wechselwirken die Moleküle nicht mehr miteinander, das Material bricht oder verformt sich dauerhaft.
Nicht alle Energie, die zur Deformation eines Polymerstücks aufgebracht wird, wird beim Entlasten wieder freigesetzt. Ein Bruchteil wird in Wärmeenergie umgewandelt. Kautschuk ist also gleichzeitig elastisch (ein Teil der mechanischen Energie wird bei Dehnung gespeichert und bei Entlastung wieder abgegeben) und viskos (ein Teil der mechanischen Energie geht in Wärme über); er ist also viskoelastisch.
Die Viskoelastizität der Elastomerketten setzt sich zusammen aus der Bewegung einzelner Kettensegmente, kürzerer wie längerer. Jedes Segment hat seine eigene Bewegungsfrequenz, die sich auch mit der Temperatur ändert. Die Bewegungsfrequenz eines jeden Kettensegments hängt von den Monomeren ab, aus denen sich die Ketten zusammensetzen. Die Gesamtheit aller Frequenzen über die Temperatur nennt man viskoelastisches Spektrum. Häufig wird dieses viskoelastische Spektrum als Änderung der Steifigkeit oder des Moduls über die Temperatur dargestellt; der Modul bei einer Temperatur setzt sich aus der Summe aller bei dieser Temperatur angeregten Kettenbewegungen zusammen, die einer Deformation folgen können. Bei dieser Form der Darstellung wird schnell deutlich, wann die Beweglichkeit der Ketten einsetzt, nämlich bei der Glastemperatur Tg. Oberhalb der Glastemperatur sinkt der Modul um drei Größenordnungen, von „glashart“ auf „gummiweich“.
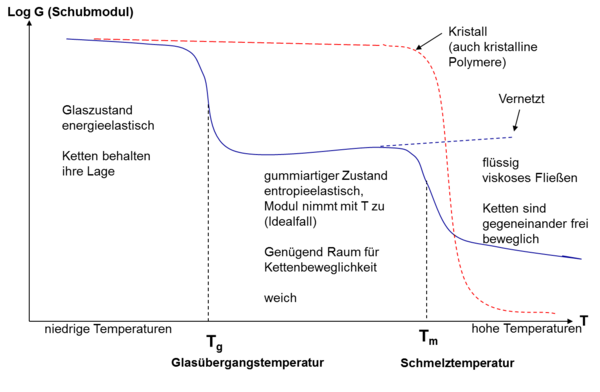
Änderung des Moduls eines Elastomers mit der Temperatur. © Annette Lechtenboehmer
Wie stark die Molekülkonfiguration die Glastemperatur und damit das gesamte Spektrum beeinflusst, wird klar, wenn man sich die typischen Reifenpolymere ansieht:
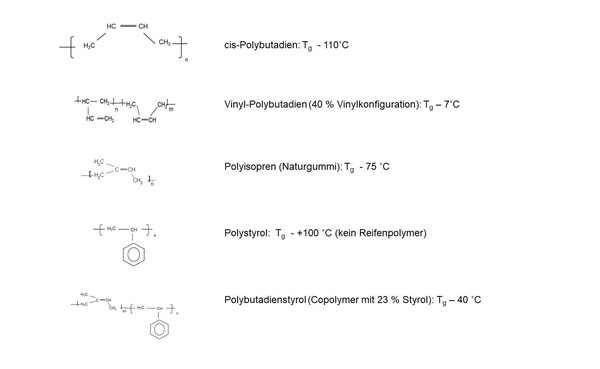
© Annette Lechtenboehmer
Die Glastemperatur wird direkt beeinflusst durch die Polymerkettenbeweglichkeit – je beweglicher die Kettensegmente (von einigen Monomeren Länge), umso niedriger die Glastemperatur.
Gummimischungen können durch weitere Zuschläge in ihren Eigenschaften verändert und angepasst werden, z.B. durch Füllstoffe, Pigmente, Öle oder Harze. Ihre viskoelastischen Eigenschaften werden dadurch modifiziert, aber nicht gelöscht. Vernetzungen in Elastomeren können durch kovalente oder ionische Bindungen erreicht werden.
Zurück zum Reifen:
Das Material eines Reifens muss in einem weiten Temperaturbereich elastisch und gummiartig sein: ein Reifen soll an einem kalten Wintermorgen ebenso elastisch sein wie an einem heißen Tag auf heißem Asphalt. Dazu sollte der Reifen immer wenig Energie beim Abrollen verlieren, also niedrigen Rollwiderstand haben. Die trotzdem verlorengehende Energie erwärmt den Reifen: wer tüchtig „Gummi gibt“, fährt „einen heißen Reifen“.
Reifentaugliche Elastomere sind im gesamten Temperaturfenster zwischen etwa – 40 und +100 C gummiartig und haben auch als Gummimischung geringe Energieverluste.
Weiter eingeschränkt wird die Auswahl dadurch, dass Reifenmischungen kovalent vernetzt sein müssen, um ihre Form auch unter dem Gewicht eines Fahrzeugs, den Kräften beim Beschleunigen, Bremsen und Lenken (Seitenkräften) standzuhalten. Die Vernetzung mit Schwefel, die klassische Vulkanisation, bietet sich an: sie lässt sich gut kontrollieren und kann auf die erforderlichen Eigenschaften abgestimmt werden. Bei der Vulkanisationsreaktion werden einzelne Moleküle durch Schwefelbrücken miteinander verbunden.
Naturgummi (NR) und sein synthetisches Gegenstück Polyisopren (IR), Polybutadien (BR) und Polystyrolbutadien (SBR) mit einem Styrolgehalt von unter 40 % erfüllen diese Bedingungen, sie sind schwefelvernetzbar und haben eine niedrige Glastemperatur. Polybutadien besteht aus Monomeren in drei Konfigurationen: als Vinylgruppe oder in cis- oder trans- Konfiguration.
Polystyrolbutadien enthält dazu noch Styrol als Monomer. Durch Änderung der Konzentration der verschiedenen Monomere in der Kette kann die Kettenbeweglichkeit der gesamten Kette und damit das gesamte viskoelastische Spektrum beeinflusst werden. Reifenmischungen werden neben den Vernetzungszuschlägen zusätzlich mit Füllstoffen wie Ruß oder Silika versetzt, um die im Reifen notwendige Festigkeit, Abriebs- und Reißfestigkeit zu erreichen.
Reifen – eine Art Luftballon?
Die erste, offensichtliche Funktion von solch einer Gummimischung ist die Dämpfung von Straßenunebenheiten und geräuschloses Abrollen: durch seine Verformbarkeit schluckt Gummi Unebenheiten. Dafür allein reichte ein dicker Gummiring – wie bei den Vollgummireifen eines Gabelstaplers.
Doch ein Autoreifen ist wesentlich komplexer: die meisten Fahrzeugreifen sind Luftreifen. Das erhöht die Flexibilität. Da ein Teil der Struktur Luft ist, wird weniger Energie beim Abrollen in Wärme umgewandelt - folglich erwärmt sich der Reifen weniger.
Der Reifen ist also ein Ballon, der – natürlich – so luftundurchlässig wie möglich sein sollte. Dies wird durch einen eingelegten Schlauch erreicht, der aus Butylkautschuk (IIR) besteht. Im Butylkautschuk sind die Polymerketten dicht gepackt, und damit ist dieses Polymer etwa zehnmal so undurchlässig für Sauerstoff und Stickstoff (vulgo: Luft) als andere Reifenpolymere.
Im schlauchlosen Reifen ist der Schlauch eingebaut; die innerste Schicht besteht aus Halobutylgummi. Halobutylpolymere erlauben Co-Vulkanisation mit einem schwefelbasierten System. Zudem enthalten diese Polymere einen geringen Prozentsatz an Kettengliedern mit Doppelbindungen - damit wird eine Co-Vulkanisation durch Schwefel mit den anderen Reifenkomponenten zusätzlich ermöglicht. Butyl– und Halobutylkautschuk sind im gleichen Temperaturbereich elastisch wie die anderen Reifenpolymere.
Der Reifen – eine Art Luftballon, wenn auch etwas robuster als der Ballon für einen Kindergeburtstag?
Die Antwort – man ahnt es – ist „nein“. Im zweiten Teil geht es weiter, und die viskoelastischen Eigenschaften kommen noch einmal zum Tragen.
Autorin: Dr. Annette Lechtenboehmer (mit freundlicher Unterstützung der Firma Goodyear)
Redaktionelle Bearbeitung: Lisa Süssmuth, GDCh

Kommentare
Keine Kommentare gefunden!