Festphasensynthese in der Polymerchemie

100 Jahre Makromolekulare Chemie
Die Natur ist eine Meisterin der Präzision, wenn es um die Herstellung großer Moleküle geht. Biopolymere wie Proteine, unsere DNS oder auch Glykane sind aus kleineren Bausteinen, den Aminosäuren, Nucleotiden oder Monosacchariden aufgebaut. Die Natur sorgt beim Aufbau dafür, dass eine exakte Anzahl und auch Position der Bausteine – die sogenannte Sequenz – erhalten wird. Diese Präzision ist von großer Wichtigkeit. Schon eine falsch eingebaute Aminosäure in einem Protein, eine vertauschte Base der DNS oder ein veränderter Zucker können dazu führen, dass sich ein Krankheitsbild entwickelt oder der Organismus seine Lebensfähigkeit verliert. Das bedeutet aber auch, wenn wir z. B. Proteine oder Zucker synthetisch herstellen und als Wirkstoffe einsetzen wollen, muss auch im Labor eine sehr hohe Präzision erreicht werden.
Das Problem der Sequenz in synthetischen Polymeren
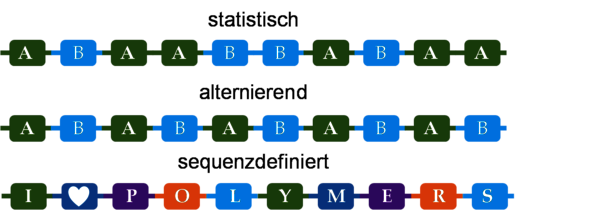
Im Vergleich zu den Biopolymeren erscheinen synthetische Polymere häufig recht einfach. Betrachten wir etwa das Polyethylen, das Material der Plastiktüte: Es besteht nur aus einem Baustein, dem Ethylen, der sich aber tausendfach wiederholt. Ein anderer wichtiger Unterschied ist die sogenannte Dispersität: Synthetische Polymere sind üblicherweise dispers, d. h. sie sind Mischungen von Ketten verschiedener Länge. Noch komplexer wird es für Polymere, die aus verschiedenen Bausteinen aufgebaut sind, den sogenannten Copolymeren. Wie bei den Biopolymeren können wir hier nun nach der Sequenz, also der Reihenfolge der Bausteine in der Kette, fragen. Allerdings gibt es für die typischen synthetischen Polymere nur eingeschränkte Möglichkeiten der Sequenz, z.B. eine streng alternierende oder statistische Verteilung.
Schon seit vielen Jahren fragen sich daher Polymerchemikerinnen und Polymerchemiker, ob es nicht möglich ist, auch synthetische Polymere nach dem Vorbild der Präzision der Biopolymere sequenzdefiniert und in einheitlicher Kettenlänge (monodispers) herzustellen. Das Materialverhalten, die physikalischen und chemischen Eigenschaften der Polymerketten werden von der Sequenz sowie der Länge der Strukturen beeinflusst. Gerade für den Einsatz von Polymeren in der Medizin ist die absolute Kontrolle über die Stoffeigenschaften und somit die Erzeugung von Sequenz von großer Bedeutung. Tatsächlich können wir uns in der sequenzkontrollierten Synthese auf Methoden der Biopolymere stützen – nämlich die Festphasensynthese.
Die Festphasensynthese zur Herstellung biologischer Polymere
Der Festphasensynthese gelang der Durchbruch nachdem Robert B. Merrifield im Jahr 1963 ein Manuskript veröffentlichte, in dem er die Synthese von Peptiden und Proteinen durch die Verknüpfung von Aminosäuren an einer Festphase vorstellte. Die Festphase sind Harzkugeln aus vernetztem Polystyrol, die reaktive Gruppen tragen und in verschiedenen Lösungsmitteln quellen, sich aber nicht auflösen. An die reaktiven Gruppen der Festphase kann dann ein erster Baustein gekuppelt werden. Wichtig für den Erfolg der Festphasensynthese ist, dass diese Kupplung zu annähernd 100 % an allen verfügbaren Gruppen erfolgt. Nur dann kann in einem zweiten Schritt der nächste Baustein angebracht werden, dann der dritte usw. bis zur gewünschten Kettenlänge. Wenn es zu geringerem Umsatz kommt, entstehen sogenannte Fehlstellen. Um dies zu vermeiden, werden u. a. die Bausteine in großem Überschuss, z. B. zehnfach, eingesetzt. Dies bedeutet aber auch, dass die übrigen Bausteine nach der Kupplung wieder entfernt werden müssen. Hier kommt ein entscheidender Vorteil der Festphase ins Spiel: Die überschüssigen Bausteine können durch eine einfache Filtration entfernt werden und müssen nicht, wie sonst üblich, mittels aufwendiger chromatographischer Reinigung vom Produkt getrennt werden. Die Sequenz wird in der Festphasensynthese einfach durch die Reihenfolge der Bausteine während der Synthese gesteuert.
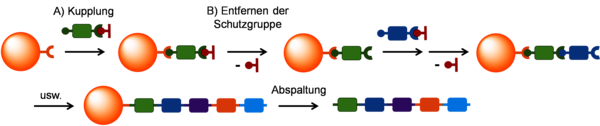
Das allgemeine Prinzip der Festphasensynthese mit Schutzgruppen.
Für Bausteine wie die Aminosäuren kommt noch ein weiterer Punkt hinzu. Sie besitzen zwei unterschiedliche funktionelle Gruppen, die miteinander reagieren können – die Säure- und die Amingruppe. Um unerwünschte Nebenreaktionen bei der Kupplung zu vermeiden, wird die Amingruppe mit einer Schutzgruppe, z. B. der Fluorenylmethoxycarbonyl-(Fmoc-)Gruppe, blockiert. Nach der Kupplung des Bausteins an der Festphase muss diese Schutzgruppe dann entfernt werden und kann wiederum durch einfache Wasch- und Filtrationsschritte vom Produkt getrennt werden. Nach dem Erhalt der gewünschten Sequenz und Kettenlänge wird das Polymer dann von der Festphase abgespalten und isoliert.
Die Übertragung auf synthetische Polymere
Um nun beliebige, auch nicht-biologische, sequenzkontrollierte Polymere herzustellen, müssen insbesondere neue Bausteine gefunden und entwickelt werden. Je nach der Art der Verknüpfung in der Hauptkette können diese Bausteine auf die reaktiven Gruppen zurückgreifen, die aus der Biopolymersynthese bereits bekannt sind und es werden so z. B. bereits sequenzdefinierte Polyamide erzeugt. Es sind aber auch andere Verknüpfungen möglich und so prinzipiell eine Vielzahl von Polymerarten zugänglich. Wichtige Vorteile der Festphasensynthese bleiben dabei erhalten, wie ihre hohe Präzision und leichte Handhabung. Zudem muss die Festphasensynthese nicht per Hand durchgeführt, sondern es können sogenannte Synthesizer eingesetzt werden. Diese Geräte führen die Reaktionsschritte an der Festphase vollautomatisiert durch und können parallel eine Vielzahl verschiedener Sequenzen erzeugen. Mögliche Nachteile der Festphasensynthese sind eine Limitierung in der Kettenlänge und der hohe Materialaufwand sowie die daraus resultierenden hohen Kosten. Das ist zum Teil auf die im Überschuss eingesetzten Bausteine zurückzuführen, die aber bereits in ausgewählten Fällen recycelt und erneut genutzt werden können.
Während in den letzten Jahren viele neue Synthesewege zur Herstellung sequenzdefinierter Polymere entwickelt wurden, steht nun mehr und mehr die Frage nach der Anwendung solcher Materialien im Vordergrund. Auch hier dient die Natur als wichtiges Vorbild: Inspiriert von der DNS können auch synthetische Polymere zur Datenspeicherung genutzt werden. Analog zur Ausbildung komplexer Strukturen der Proteine kann die Struktur von Polymeren kontrolliert werden. Im Nachbau der natürlichen Zuckerstrukturen können sequenzdefinierte Zuckerpolymere erzeugt werden, die im Kampf gegen bakterielle oder virale Infektionen helfen. Wir sind gespannt, was die Festphasensynthese auch in Zukunft an neuen Materialien ermöglicht!

Beispiele für sequenzdefinierte biologische (Peptid) und synthetische (Glycooligoamidoamin) Makromoleküle mittels Festphasensynthese. Einzelne Bausteine sind farblich hervorgehoben.
Autoren: M.Sc. Lukas Fischer und Prof. Dr. Laura Hartmann,
Heinrich-Heine-Universität Düsseldorf, Institut für Organische Chemie und Makromolekulare Chemie
Redaktionelle Bearbeitung: Maren Mielck, GDCh
Literatur:
Die Einführung der Peptidsynthese: Merrifield, R. B. "Solid phase peptide synthesis. I. The synthesis of a tetrapeptide." Journal of the American Chemical Society, 1963, 85.14, 2149-2154. https://pubs.acs.org/doi/10.1021/ja00897a025
Aktuelle Übersichtsartikel zur Synthese sequenzdefinierter, synthetischer Polymere:
Hill, S. A.; Gerke, C.; Hartmann, L. "Recent Developments in Solid-Phase Strategies towards Synthetic, Sequence-Defined Macromolecules". Chemistry – An Asian Journal, 2018, 13, 3611-3622. https://doi.org/10.1002/asia.201801171
Solleder, S. C.; Schneider, R. V.; Wetzel, K. S.; Boukis, A. C.; Meier, M. A. R. „Recent Progress in the Design of Monodisperse, Sequence-Defined Macromolecules”. Macromolecular Rapid Communications, 2017, 38, 1600711. https://onlinelibrary.wiley.com/
Lutz, J.F. “Defining the Field of Sequence-Controlled Polymers”. Macromolecular Rapid Communications, 2017, 38, 1700582. https://onlinelibrary.wiley.com/doi/epdf/10.1002/marc.201700582

Kommentare
Keine Kommentare gefunden!