Energie speichern mit Polymeren

100 Jahre Makromolekulare Chemie
Unser Alltag wird zunehmend „mobiler“ und verschiedenste Energiespeicher sind inzwischen essentiell geworden. Ohne entsprechende Batterien bzw. Akkus würden keine Mobiltelefone, Tablets oder Laptops funktionieren. Und auch im Bereich der Mobilität sind Batterien für Elektroautos, E-Bikes und E-Scooter mitten in unserem Alltag angekommen.
In diesem Zusammenhang begegnet uns auch die Lithium-Polymer-Batterie – kurz LiPo genannt, die inzwischen in Mobiltelefonen, Laptops und auch im Modellbau zu finden ist.
Was macht das Polymer in der Lithium-Ionen-Batterie?
In der Lithium-Polymer-Batterie (LIB) findet sich das namensgebende Polymer im Elektrolyten. Dieser Elektrolyt wird in der LIB zum Transport der Lithiumionen zwischen den beiden Elektroden (Graphit bzw. Lithiummetalloxide, Lithiumeisenphophat) beim Laden bzw. Entladen benötigt. Flüssige organische Elektrolyte (z.B. Carbonate) zeigen zwar sehr gute Leitfähigkeiten, haben aber ein intrinsisches Sicherheitsproblem: Der brennbare Elektrolyt kann auslaufen. Daher werden Polymere (z.B. Polyvinylidendifluorid) im Elektrolyten verwendet, um ein Gel zu erhalten, das nicht ausläuft.
Eine noch höhere Sicherheit, auch bei der Verwendung von Metallanoden (d.h. Lithiumfolien), versprechen Polymerfestelektrolyte (d.h. Polymer + Lithiumsalz).[1] Noch weisen diese Festelektrolyte oftmals geringere Leitfähigkeiten im Vergleich zu Flüssig- oder Gelelektrolyten auf, vor allem bei tieferen Temperaturen. Nichtsdestotrotz werden Polymerfestelektrolyte bereits in kommerziellen Batterien verwendet, so z.B. im BlueCar von Bolloré.[2]

Lithium-Polymerbatterie aus einem Mobiltelefon. © M. D. Hager
Kann ein Polymer auch selbst Strom speichern?
Typischerweise sehen wir Polymere, also Kunststoffe/Plastik, im Zusammenhang mit elektrischem Strom als Isolatoren – so z.B. die Kunststoffummantelung von Stromkabeln (aus PVC, Polyvinylchlorid). Spätestens seit der Verleihung des Nobelpreises für Chemie im Jahr 2000 an Ian MacDiarmid, Alan Heeger und Hideki Shirakawa, stehen vermehrt leitfähige Polymere im Vordergrund. Diese konjugierten Polymere können hierbei Leitfähigkeiten im Bereich von anorganischen Halbleitern, teilweise sogar von Metallen erreichen.
So verwendeten beispielsweise BASF und Varta Ende der 1980er-Jahre das konjugierte Polymer Polyanilin als Aktivmaterial in Kombination mit Lithium. Kommerzielle Knopfzellen konnten sich allerdings nicht durchsetzen – auch aufgrund einer schwankenden Zellspannung, insbesondere aber wegen des beginnenden Siegeszugs der Lithiumbatterie.
Organische Radikalbatterien
Erst in den 2000er-Jahren erlebten Polymer-basierte Batterien wieder eine Renaissance. Mit der Entwicklung der organische Radikalbatterie (ORB) in Japan konnten neue interessante Batterien geschaffen werden.[3]
Ein 2,2,6,6-Tetramethylpipeidinyloxyl (TEMPO)-haltiges Polymer (PTMA – Poly (2,2,6,6-tertramethylpiperidinyloxy-4-yl-meth-acrylat) wird mit einem Kohlenstoffmaterial vermischt. Dies soll für eine bessere elektrische Leitfähigkeit sorgen, anschließend wird es zu Elektroden verarbeitet. Beim Laden wird das Polymer oxidiert, während sich auf der Seite der Anode Lithium abscheidet. Das besondere an diesen Batterien ist, dass sie sehr schnell, innerhalb weniger Minuten oder auch Sekunden, vollgeladen sind. Deshalb sind diese Batteriesysteme für die Forschung interessant und werden weiter intensiv untersucht – so auch im DFG Schwerpunktprogramm SPP 2248 „Polymer-basierte Batterien“.[4]
Zudem nähern sich diese Systeme auch der kommerziellen Anwendung als druckbare Batterie. Der Vorteil von Aktivmaterialien auf Kunststoffbasis liegt in einer einfachen Verarbeitung, welche vergleichsweise geringe Energie braucht. Auch druckbare Batterien können verwirklicht werden.
Im Vergleich zu Lithium-Ionen-Batterien werden mit ORBs allerdings geringere Energiedichten erreicht.

Oben links: PTMA und Kohlenstoffadditiv mit Binder, oben rechts: Redoxreaktion des PTMAs; unten links: Schematische Darstellung der geladenen Batterie (rechts) und der entladenen Batterie (links); unten rechts: Polymerbatterie am Potentiostaten. © Dr. Martin D. Hager und Prof. Dr. Ulrich S. Schubert
Polymer-Redox-Flow-Batterie
Neben den kleinen druckbaren Polymer-basierten Batterien, gibt es auch Polymere für Redox-Flow-Batterien (RFB).[5] Hierbei werden flüssige Elektrolyte eingesetzt, also wasserlösliche
Polymere in Wasser mit Kochsalz. Durch die großen Makromoleküle können Dialysemembranen ionenleitenden Membranen, welche in konventionellen RFBs verwendet werden, ersetzen. Die Elektrolyte werden in großen Speichertanks gelagert. Die RFB die einzige Batterietechnologie, bei der die Leistung (bestimmt durch die Zellstapel) und die Kapazität (bestimmt durch die Größe der Tanks) unabhängig voneinander skaliert werden kann. Hierdurch stellen diese mögliche Systeme für stationäre Energiespeicher dar.
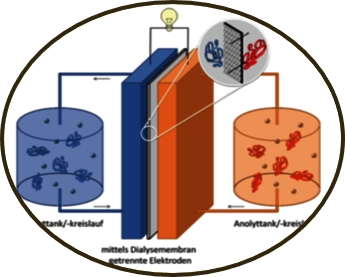
Schema einer Polymer-Redox-Flow-Batterie. © Dr. Martin D. Hager und Prof. Dr. Ulrich S. Schubert
Autoren: Dr. Martin D. Hager und Prof. Dr. Ulrich S. Schubert (Friedrich-Schiller-Universität Jena, Lehrstuhl für Organische Chemie und Makromolekulare Chemie & Center for Energy and Environmental Chemistry Jena (CEEC Jena))
Redaktionelle Bearbeitung: Lisa Süssmuth, GDCh
Titelbild: © Raimond Spekking / CC BY-SA 4.0 (via Wikimedia Commons), Samsung Li-ion polymer battery, Model AB553850DE-9738, CC BY-SA 4.0
[1] J. Kalhoff, G. G. Eshetu, D. Bresser, S. Passerini, ChemSusChem 2015, 8, 2154-2175.
[2] https://chargedevs.com/newswire/renault-and-bollore-collaborate-on-assembly-car-sharing-and-a-new-3-seat-version-of-the-bluecar/ (Zugriff am 29.01.2020)
[3] K. Nakahara, S. Iwasa, M. Satoh, Y. Morioka, J. Iriyama, M. Suguro, E. Hasegawa, Chem. Phys. Lett. 2002, 359, 351-354.
[4] www.spp2248.uni-jena.de
[5] https://corporate.evonik.com/en/pages/article.aspx?articleId=109783
[6] T. Janoschka, N. Martin, U. Martin, C. Friebe, S. Morgenstern, H. Hiller, M. D. Hager, U. S. Schubert, Nature 2015, 527, 78-81.

Kommentare
Keine Kommentare gefunden!