Wie funktionieren eigentlich… Wasserenthärter?

Hartes Wasser? Ein Paradoxon? Schätzt man doch jeden Morgen die weichen Wasserstrahlen unter der Dusche als äußerst angenehme Eigenschaft des Wassers. Aber „hartes“ Wasser? Wenn schon, dann aber doch nur bei einer Temperatur unter 0 Grad Celsius in Form von Eiszapfen oder? Mitnichten!
Was ist Wasserhärte?
Was bedeutet nun also hartes und weiches Wasser, wie misst man die Wasserhärte und warum spielt sie in unserem Leben eine so herausragende Rolle? Das muss irgendetwas mit Chemie zu tun haben. Schaut man in Wikipedia nach, dann findet man dort: „In der Wasserchemie bezeichnet der Begriff Wasserhärte die Stoffmengenkonzentration der im Wasser gelösten Kationen der Erdalkalimetalle und in speziellen Zusammenhängen auch die zugehörigen anionischen Partner“ [1].
Aha, also Calcium- und Magnesiumsalze beeinflussen die Wasserhärte (die übrigen Erdalkalimetalle Beryllium, Strontium, Barium und Radium spielen hier keine Rolle). Die Wasserhärte wird in sogenannten Härtegraden gemessen, indem man die Konzentration der Salze durch quantitative Analyse ermittelt und sie von 0 bis 21 Grad deutscher Härte (dH) skaliert. Je höher also der Gehalt dieser Salze ist, desto härter ist das Wasser. Weiches Wasser hat eine Härte zwischen 0 und 8 Grad dH, mittelhartes von 8-14 Grad dH und hartes Wasser darüber.
Oft hört man auch den Begriff der temporären und permanenten Wasserhärte. Unter temporärer Härte versteht man den Gehalt an Calcium- und Magnesiumhydrogencarbonat im Wasser. Bringt man das Wasser zum Kochen, führt das dazu, dass schwer lösliche Calcium- und Magnesiumcarbonate ausfallen und die Wasserhärte verringert wird, daher der Begriff temporäre Härte. Die permanente Wasserhärte wird durch gelöste Sulfate, Nitrate und Chloride verursacht und kann nicht durch Erhitzen entfernt werden [2].
Aber welche Auswirkungen haben nun diese unterschiedlichen Härtegrade auf unser alltägliches Leben? Generell kann man sagen: Je weicher das Wasser, umso problemloser seine Verwendung. Weiches Wasser schmeckt neutraler, während hartes Wasser einen markanteren Geschmack hat. Hartes Wasser führt zu vermehrten Ablagerungen in Wasserrohren, Kesseln, Elektrogeräten und Waschmaschinen und sollte daher „entkalkt“, also in weiches Wasser umgewandelt werden.
Methoden der Wasserentkalkung
Hier gibt es eine Reihe unterschiedlicher Möglichkeiten: vom simplen Auskochen mit Calciumhydroxid (Kalk-Soda-Verfahren), durch Ionenaustauscher (Harze, Membranen, Zeolith A) bis hin zu Komplexbildnern (Polyphosphate) und der Vollentsalzung (Kombination von Kationen- und Anionenaustauscher, Umkehrosmose und Destillation). Übrigens, Wasserhärte 0 hat das Regenwasser, das sich ja durch Verdampfen und Sublimieren in der Wolke ansammelt und dann salzlos der Erde wiedergegeben wird.
Zur Befreiung des Wassers von seiner Erdalkali-Salzfracht sind besonders das Ionenaustauerverfahren und die Umkehrosmose interessant.

Abb. 1: Ionenaustauschersäule (Foto: TimVickers, Ion exchange column, Wikimedia Commons, gemeinfrei)
Ionenaustauschverfahren
Ionentauscher oder Ionenaustauscher sind Materialien, mit denen gelöste Ionen durch andere Ionen gleicher Ladung (d. h. positiv oder negativ) ersetzt werden können; es findet demnach ein Ionentausch statt. [3]. Sie bestehen entweder aus einem Ionenaustauscherharz, das in Form von Säulen bzw. Kartuschen und Membranen vorliegt oder als mineralische Zeolithe.
Das Wasser, das enthärtet werden soll, fließt durch den Ionenaustauscher. Dort werden die „unerwünschten“ Calcium- und Magnesium-Ionen an das Harz des Ionenaustauschers gebunden. Im Gegenzug wird eine äquivalente Ladungsmenge von Natrium-Ionen des Ionenaustauschers an das Wasser abgegeben. Das bedeutet, das ein Ca2+-Ion gegen zwei Na+-Ionen ausgetauscht wird, ebenso ein Mg2+-Ion gegen zwei Na+-Ionen.
Zeolithe sind natürliche wie auch künstliche kristalline Alumosilikate mit einer mikroporösen käfigartigen Gerüststruktur. Sie sind Salze aus Kationen (meist Na+-Kationen) und einem anionischen Kristallgitter aus AlO2- - und SiO2- Einheiten. Auch hier erfolgt die Wasserenthärtung über den Austausch der Ca2+- und Mg2+-Ionen gegen die Na+-Ionen. Ca2+ und Mg2+-Ionen werden im anionischen Kristallkäfig „eingesperrt“ und somit unschädlich gemacht. Das entstehende Natriumcarbonat (Na2CO3) beeinflusst die Wasserhärte nicht mehr.
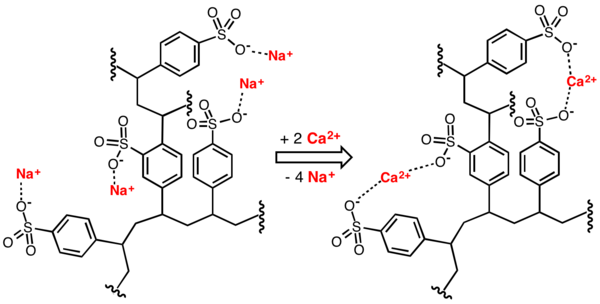
Abb. 2: Schematische Präsentation eines Wasserenthärtungsprozesses: Calciumionen im Wasser werden durch Natriumionen ersetzt. Die Calciumionen werden vom Ionenaustauscher gebunden.
(Abb: Smokefoot,CationExchCartoon, Wikimedia Commons, gemeinfrei)
Umkehrosmose
Bei der Umkehrosmose wird Leitungswasser durch eine semipermeable (halbdurchlässige) laserperforierte Membrane mit ultrafeinen Poren gepresst, wobei ein molekularer Trennungsprozess stattfindet: Die Wassermoleküle können die Membrane passieren, während die gelösten Stoffe wie Calcium- und Magnesiumsalze zu 90 - 99% je nach Moleküldurchmesser zurückgehalten werden.
Wir halten fest: Hartes und weiches Wasser unterscheiden sich durch die unterschiedlichen Konzentrationen von Erdalkalisalzen wie Calciumcarbonat und Magnesiumsulfat. Um möglichst weiches Wasser zu erzeugen, das wasserführende Systeme vor Verkalkung schützt, müssen diese Salze entfernt werden. Dies gelingt vornehmlich durch Ionenaustausch mit natürlichen und industriell verfügbaren Technologien.
Quellen
[1] https://de.wikipedia.org/wiki/Wasserhärte
[2] https://www.lernhelfer.de/schuelerlexikon/chemie/artikel/wasserhaerte
[3] https://de.wikipedia.org/wiki/Ionenaustauscher
Der Beitrag wurde vom Arbeitskreis Öffentlichkeitsarbeit der Seniorexperten Chemie, einer Fachgruppe der Gesellschaft Deutscher Chemiker, erstellt.
Autor: Prof. Dr. Klaus-Peter Jäckel (bearbeitet durch kjs, Redaktion FaszinationChemie)
In der Reihe „Was ist eigentlich…“ stellen wir in leicht verständlicher Form chemische Substanzen vor, die jeder kennt oder fast jeder benutzt. Alle Beiträge der Reihe: https://faszinationchemie.de/chemie-ueberall
Titelfoto: ronymichaud/pixabay

Kommentare
Keine Kommentare gefunden!