Was sind eigentlich Enantiomere?

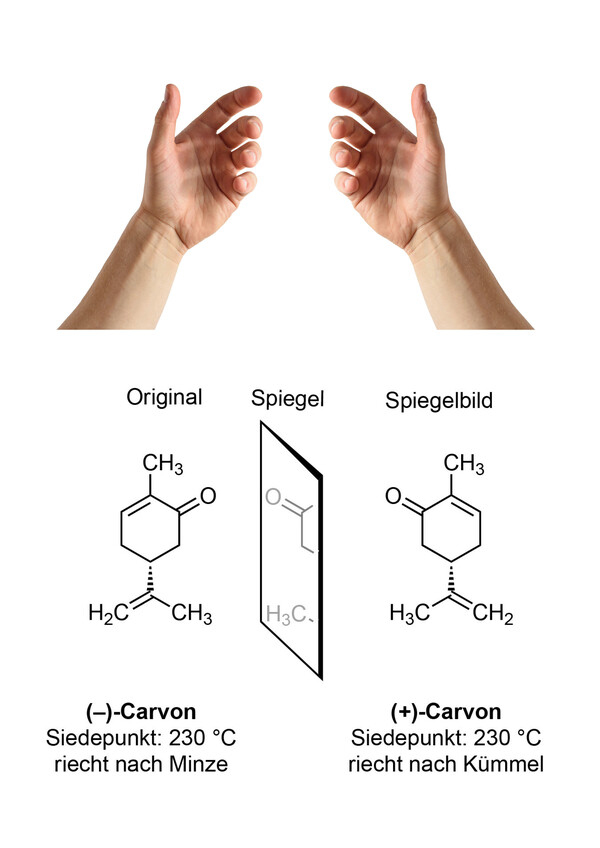
Um Enantiomere zu verstehen, kann man zunächst eine andere Frage stellen: Ist die linke Hand gleich der rechten Hand? Die Finger haben jeweils die gleiche Reihenfolge und sind räumlich gleich aufgebaut. Trotzdem weiß jeder, was eine linke und was eine rechte Hand ist – sie sind nicht gleich, sondern spiegelbildlich (Abb.1).
Genau wie mit den beiden Händen steht es um manche Molekülpaare. Sie sehen aus wie Bild und Spiegelbild – und lassen sich auch durch Drehen und Schieben nicht zur Deckung bringen. Bei den beiden Molekülen handelt es sich dann um Enantiomere.
Ein Molekül, dessen Spiegelbild ein anderes Molekül ergibt, ist chiral – wie die linke Hand, die gespiegelt zur rechten wird. Das Konzept, das diese Fragen abdeckt, heißt Chiralität.
Wie man Enantiomere entlarvt
Zwei Enantiomere sind in den meisten chemischen und physikalischen Eigenschaften gleich: Die beiden Feststoffe schmelzen beispielsweise bei der gleichen Temperatur; Öle sieden bei der gleichen Temperatur, bei (–)-Carvon und (+)-Carvon sind das je 230 °C (Abbildung 1).
Es gibt aber Eigenschaften, in denen sich die beiden Enantiomere unterscheiden. Das zeigt sich zum Beispiel, wenn man je eine Lösung herstellt und diese mit linear polarisiertem Licht durchleuchtet. Ein Enantiomer dreht die Polarisationsebene dieses Lichts um einen bestimmten Betrag nach rechts und das andere Enantiomer um den gleichen Betrag nach links. Deshalb stellt man den Namen der Verbindungen oft ein (+) für rechtsdrehend oder ein (–) für linksdrehend voran.
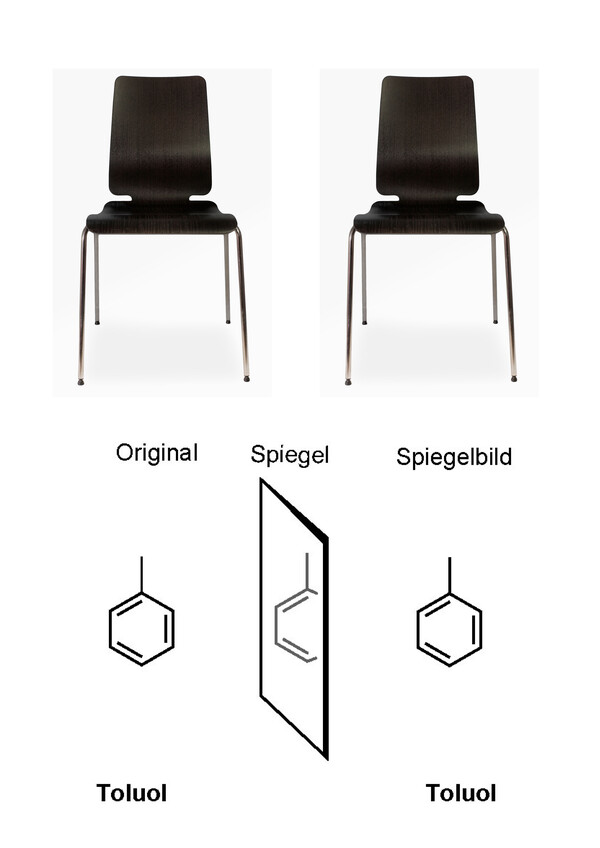
Es gibt auch Moleküle, die nicht chiral sind. Spiegelt man sie, kommen sie genauso heraus, wie sie hineingegangen sind. Ein Beispiel aus der echten Welt: der Stuhl. Beispiel aus der chemischen Welt: die Verbindung Toluol.
Im Körper wirken sie unterschiedlich
Enantiomere unterscheiden sich außerdem, wenn sie asymmetrischer Umgebung ausgesetzt werden. Das passiert zum Beispiel in der Nase. Unsere Geruchsrezeptoren bestehen aus Aminosäuren – diese sind ebenfalls chiral, und jeweils nur eins der zwei möglichen Enantiomere ist in die Rezeptoren eingebaut.
Die aus den Aminosäuren aufgebauten Rezeptoren sind also ebenfalls chiral. Die asymmetrische Umgebung in den Rezeptoren unterscheidet zwischen den beiden Enantiomeren eines Duftstoffs. Die Folge: (–)-Carvon (Abb.1) passt besser in manche Geruchsrezeptoren und riecht deshalb nach Minze, das spiegelbildliche Isomer (+)-Carvon vermittelt den Geruch von Kümmel. Nicht nur die Nase, auch der Rest des Organismus ist auf der Molekül-Größenordnung asymmetrisch.
Medikamente: Enantiomere entscheidend
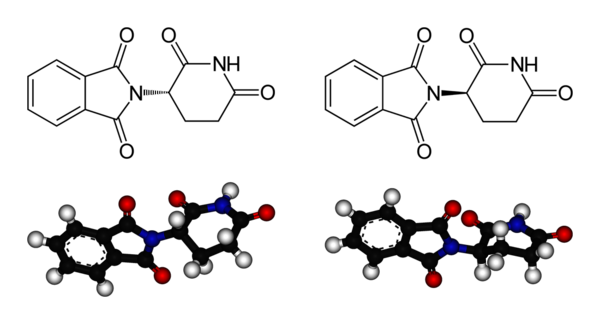
Abb.3: Chemische Formeln von S-Thalidomid (links) und R-Thalidomid (Benjah-bmm27, Thalidomide-structures, Wikimedia Commons, gemeinfrei)
Beim Medikament Thalidomid (Contergan®) wirkt das (R)-Enantiomer sedierend und wurde als Schlafmittel verwendet. Das andere Enantiomer hingegen ist embryotoxisch und war für viele Missbildungen bei Neugeborenen Ende der 1950er Jahre verantwortlich.
Um solche Nebenwirkungen zu verringern, wird von manchen Medikamenten nur eines von zwei Enantiomeren verabreicht. Im Fall von Thalidomid wären diese Schäden aber wahrscheinlich nicht zu vermeiden gewesen, da der menschliche Organismus das (R)-Enantiomer über ein Enzym in die schädliche (S)-Form umwandelt.
Der Beitrag wurde vom Arbeitskreis Öffentlichkeitsarbeit der Seniorexperten Chemie, einer Fachgruppe der Gesellschaft Deutscher Chemiker, erstellt.
Autor: Prof. Dr. Eberhard Ehlers und Dr. Luca Blicker (Redaktion FaszinationChemie)
In unserer Rubrik „Chemie überall“ geht es um chemische Verbindungen oder chemische Verfahren, die wir im Alltag nutzen oder um Substanzen, die immer mal wieder in den Schlagzeilen sind. Die Beiträge in leicht verständlicher Form sind von Chemikerinnen und Chemikern geschrieben. Alle Beiträge der Reihe: https://faszinationchemie.de/chemie-ueberall
Titelbild: penyushkin/Stock.adobe

Kommentare
Keine Kommentare gefunden!