Was ist eigentlich... Wasserstoffperoxid?

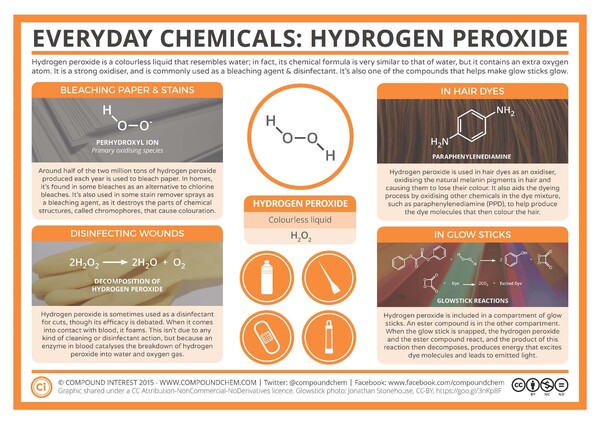
Wasserstoffperoxid ist eine farblose Flüssigkeit. Seine Formel ist H2O2. Es enthält also ein Sauerstoffatom (O) mehr als Wasser (H2O). Die Grafik von Compound Interest gibt einen Überblick über die Eigenschaften und Anwendung von Wasserstoffperoxid.
Bleich- und Oxidationsmittel
Jeder kennt den Begriff "peroxidblond." Er stammt aus der Verwendung von Wasserstoffperoxid zum Bleichen von Haaren. Aber das ist nur einer der vielen Verwendungszwecke von Wasserstoffperoxid; es ist auch in mehreren anderen Produkten zu finden, denen man regelmäßig begegnet, und sogar in einigen Raketentreibstoffen.
Am populärsten ist Wasserstoffperoxid zum Bleichen von Haaren. In Farbstoffmischungen wirkt Wasserstoffperoxid als Oxidationsmittel. Es oxidiert Melanine, organische Pigmente, die sichtbares Licht absorbieren und dem Haar seine Farbe verleihen; diese Oxidation zerstört teilweise diese Pigmente, und lässt das natürliche blasse Gelb des Keratins (das Protein, aus dem das Haar besteht) durchscheinen. Das Haarfärbemittel enthält außerdem eine alkalische Verbindung, zum Beispiel Ammoniak. Dieser hat die Aufgabe, die Haarfollikel aufzuweichen und dem Oxidationsmittel den Zugang zum Melanin zu ermöglichen. Peroxid ist auch dafür verantwortlich, andere Chemikalien in der Farbmischung zu oxidieren, um die chemischen Verbindungen zu bilden, die sich als Farbstoffe an das Haar binden.
Doch nicht nur Haare werden mit Wasserstoffperoxid gebleicht, auch dies ist nicht die häufigste Anwendung der Verbindung. Etwa die Hälfte des jährlich produzierten Wasserstoffperoxids wird zum Bleichen von Zellstoff und Papier verwendet, und es wird auch in Haushaltsbleichen als Alternative zu chlorhaltigen Verbindungen wie Natriumhypochlorit verwendet. Verwendet ihr einen Fleckenentferner, bevor ihr eure Kleidung in die Waschmaschine werft? Wahrscheinlich enthält auch dieser Wasserstoffperoxid. Es reagiert mit den Flecken-Molekülen, die meist im sichtbaren Bereich absorbieren. Deren Struktur und damit ihre Absorption wird verändert, und Flecken verschwinden.
Wasserstoffperoxid ist ein starkes Oxidationsmittel. Es wird daher auch als Desinfektionsmittel verwendet. In Apotheken ist es als 3%ige wässrige Lösung erhältlich und wird oft zur Reinigung von Schnittwunden verwendet. Wenn ihr dies einmal ausprobiert habt, werdet ihr bemerkt haben, dass es Blasen bildet, wenn es mit dem Schnitt in Berührung kommt. Das ist auf die Wirkung eines Enzyms namens Katalase im Blut zurückzuführen. Dieses Enzym katalysiert die Zersetzung von Wasserstoffperoxid in Sauerstoff und Wasser, und der entstehende Sauerstoff verursacht die Blasenbildung. Der Abbau von Wasserstoffperoxid ist eine Reaktion, die ohnehin stattfindet, das Enzym beschleunigt sie nur; deshalb wird Wasserstoffperoxid in Flaschen aus dunklem Glas gespeichert, da es schon durch Licht schneller abgebaut werden kann. Die Wirksamkeit von Wasserstoffperoxid als Desinfektionsmittel für Schnittwundene wird allerdings von manchen Leuten kritisch gesehen.
Leuchtstäbe und Raketentreibstoff
Neuerdings wird die Verbindung auch in Leuchtstäben (Knicklichtern) verwendet. Wasserstoffperoxid befindet sich in einer der Kammern des Sticks. Wenn der Leuchtstab geknackt, wird reagiert das Wasserstoffperoxid mit einem Ester aus der anderen Kammer; dabei entsteht ein Peroxysäureester, eine instabile Verbindung, die sich dann zersetzt. Dabei erzeugt sie Energie, die die Farbstoffmoleküle anregt. Wenn der angeregte Farbstoff in seinen Grundzustand übergeht, gibt er sichtbares Lichts ab, und der Leuchtstab leuchtet.
Schließlich wird Wasserstoffperoxid auch als Raketentreibstoff verwendet. In Konzentrationen von 90% und mehr zersetzt es sich entweder in Sauerstoff oder es dient als Oxidationsmittel für andere Brennstoffe wie Hydrazin. Obwohl meist flüssiger Sauerstoff in Raketentreibstoffen verwendet wird, sind bei einigen Satelliten immer noch Wasserstoffperoxid-Antriebe im Einsatz. Wasserstoffperoxid wurde früher auch in Antriebssystemen für U-Boote eingesetzt. Sein Einsatz auf dem russischen U-Boot Kursk, war für seinen Untergang verantwortlich. Ein Leck im Wasserstoffperoxid-Tank eines Torpedos hat vermutlich die Explosion verursacht, die letztendlich zum Tod aller 118 Besatzungsmitglieder führte.
Originaltext: https://www.compoundchem.com/2014/09/30/hydrogenperoxide/
Übersetzung: Wolfgang Gerhartz/kjs
In der Reihe „Was ist eigentlich…“ stellen wir in leicht verständlicher Form chemische Substanzen vor, die jeder kennt oder fast jeder benutzt. Alle Beiträge der Reihe: https://faszinationchemie.de/chemie-ueberall

Kommentare
Keine Kommentare gefunden!