Was ist eigentlich... Kochsalz?

Salz, überall um uns herum
Jeder von uns kennt, zumindest aus Abenteuergeschichten, die fatale Situation eines Schiffbrüchigen: Obwohl um ihn herum nichts als Wasser ist, droht er zu verdursten, weil das Meerwasser wegen seines zu hohen Salzgehaltes nicht trinkbar ist. Chemiker*innen verstehen unter Salzen eine chemische Verbindung aus einem positiv geladenen Teilchen (Kation) und einem negativ geladenen Teilchen (Anion). Es gibt eine Vielzahl von Salzen, aber das Salz im Meer, in der Suppe, in der Sole, das ist Natriumchlorid, auch Kochsalz genannt.
Aber zurück zum Schiffbrüchigen: schaut er unter die Meeresoberfläche, sieht er eine prächtige Vielfalt an Fischen, Langusten, Muscheln und anderen Seetieren, denen der hohe Salzgehalt des Meerwassers nichts ausmacht. Diese Unterschiede sind auch an Land zu beobachten. In der Nähe des Strandes wachsen nur „Halophyten“, salztolerante Pflanzen, wie z. B. der Strandhafer oder die Strandaster. Andere Pflanzen benötigen einen salzarmen Boden weit ab vom Meer.

Schiffbrüchige in einem Gemälde von Iwan Konstantinowitsch Aiwasowski: Die neunte Woge (1850) (Wikimedia Commons, als gemeinfrei gekennzeichnet)
Lebenswichtig für uns Menschen
Obwohl der Mensch kein Meerwasser trinken kann, verlangt er dennoch nach Salz zu seinen Speisen („Kochsalz“). Aber nicht nur des Geschmacks wegen – Brot ohne Salz ist fad. Natriumchlorid ist für Menschen und Tiere der wichtigste lebensnotwendige Mineralstoff. Der Organismus benötigt Natriumchlorid z.B. zur Bildung der Magen‐Salzsäure, für die Nervenleitung und Muskelerregung. Das mit Schweiß und Harn ausgeschiedene Salz muss ersetzt werden (ca. 6 g/Tag bei mäßiger körperlicher Arbeit).
Chemisch betrachtet ist Natriumchlorid, also unser Kochsalz, das Natriumsalz der Salzsäure (HCl) und hat die Formel NaCl. Es besteht also aus den Elementen Natrium (Na) und Chlor (Cl). Es gehört zur Faszination der Chemie, dass beide Elemente in ihrer reinen Form völlig andere Eigenschaften haben als ihre Verbindung Natriumchlorid (s. die Beiträge zu Natrium und Chlor). Während unser Körper Kochsalz nicht nur verträgt, sondern (siehe oben) auch braucht, ist elementares Chlor (Cl2) so giftig, dass es im ersten Weltkrieg als Kampfgas eingesetzt wurde. Auch elementares Natrium muss mit großer Vorsicht behandelt werden, weil es im Kontakt mit Wasser explodiert.
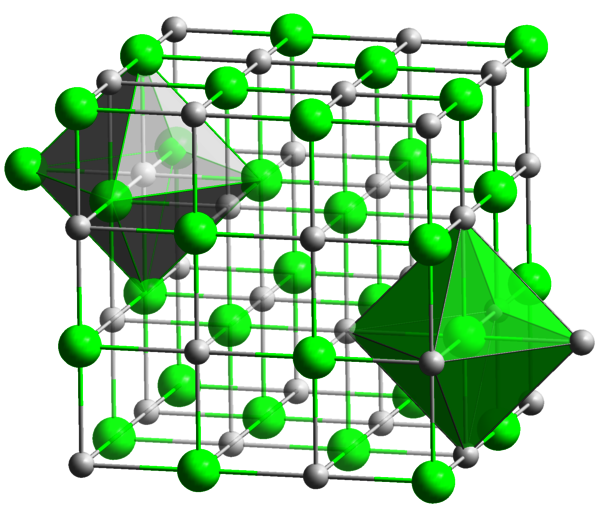
Chemische Struktur von Natriumchlorid: Die Na+-Ionen sind grau, die Cl--Ionen grün gekennzeichnet. Jedes Natrium-Ion ist von sechs Chlorid-Ionen umgeben, die einen Oktaeder bilden. Ebenso ist jedes Chlorid-Ion von sechs Natrium-Ionen umgeben. (Wikimedia Commons, als gemeinfrei gekennzeichnet.)
Zurück zum Natriumchlorid, dem Kochsalz: Es kristallisiert in farblosen, durchsichtigen Würfeln und wird auch in Deutschland durch bergmännischen Abbau von Steinsalz‐Lagern gewonnen. Es kommt dann als „Gewerbesalz“, „Fabriksalz“, „Düngesalz“ oder „Viehsalz“ in den Handel. Auf Grund seiner den Gefrierpunkt senkenden Wirkung wird es auch als Streusalz im Winter eingesetzt. Technisch dient es als Ausgangsstoff für die Herstellung fast aller anderen Natriumverbindungen, wie Soda (Natriumcarbonat), Ätznatron (NaOH), oder Salzsäure (HCl). Ein zweites Verfahren zur Gewinnung ist die Siederei. So wird „Speisesalz“ erhalten, indem man Steinsalz in natürlichen Solen bis zur Sättigung auflöst und die Lösung in großen Eisenpfannen eindampft. Und als Highlight für die Gourmets wird in warmen Gebieten, wie zum Beispiel auf der Ile‐de‐Ré an der französischen Atlantikküste, das Speisesalz in Salzgärten unter Ausnutzung von Ebbe und Flut gewonnen. Dazu leitet man Meerwasser mittels eines ausgeklügelten Systems in flache, in den Sand des Strandes geformte Becken. Von besonderer Qualität ist die „Fleur de Sel“ (dt. „Salzblume“). Sie entsteht nur an heißen und windstillen Tagen als hauchdünne Schicht an der Wasseroberfläche und wird in Handarbeit mit einer Holzschaufel abgeschöpft. Als wässriges Aerosol dient Salz am Meeresstrand oder in Gradierwerken (z.B. in Bad Nauheim) als ein Heilmittel für die Atemwege. Beim Solebad im Meer oder in Thermalbädern lindert Salz Hautkrankheiten wie Neurodermitis.
Salz wurde früher als Konservierungsmittel für Fleisch („Pökelfleisch“) oder Fisch („Salzhering“) verwendet, womit es ein bedeutender Wirtschaftsfaktor war. Es verhalf den Hansestädten zu Reichtum und Macht. Die großen Backsteinkirchen in Lüneburg, Rostock und Stralsund zeugen noch heute davon.
Der Beitrag wurden vom Arbeitskreis Öffentlichkeitsarbeit der Seniorexperten Chemie, einer Fachgruppe der Gesellschaft Deutscher Chemiker, erstellt.
Autor: Dr. Wolfgang Weber (bearbeitet durch kjs)
Bildnachweis Titelbild: APPER, Speisesalz, CC BY-SA 3.0
In der Reihe „Was ist eigentlich…“ stellen wir in leicht verständlicher Form chemische Substanzen vor, die jeder kennt oder fast jeder benutzt. Alle Beiträge der Reihe: https://faszinationchemie.de/chemie-ueberall

Kommentare
Keine Kommentare gefunden!