Was Chlorate in Flugzeugen zu suchen haben

Claude Louis Berthollet hatte 1788 bei seiner Entdeckung des Kaliumchlorats nicht nur dessen Explosionskraft in Mischungen mit Kohlenstoff beobachtet, sondern auch, dass das reine Salz beim Erwärmen viel Sauerstoff abgab. Er sah darin einen eleganten Weg, bei Bedarf dieses Gas im Labor herzustellen. Er konnte nicht ahnen, dass mit seiner Entdeckung über 150 Jahre später bei akutem Sauerstoffmangel Menschenleben gerettet werden würden. Diese Seite der Chlorate ist weitestgehend unbekannt und lohnt, hier einmal gewürdigt zu werden.
Im Notfall lebensrettend: Sauerstoffmasken in Flugzeugen
Der Störfall eines plötzlichen Sauerstoffmangels droht in lebensfeindlichen Umgebungen wie in U-Booten, Taucherglocken, Raumstationen und Bergwerken. Menschen, die sich dort oft aufhalten, werden heute mit Sicherheitsunterweisungen geschult und wissen, was im Notfall zu tun ist. Das gilt im Prinzip auch für Passagiere in Verkehrsflugzeugen. Vor dem Start (Abb. 1) werden sie informiert, was bei einem Sauerstoffmangel nach Druckabfall zu tun wäre. Leider hören die meisten Passagiere nicht hin und halten diesen Störfall für unwahrscheinlich. Das stimmt leider nicht ganz, die Flugmedizinische Gesellschaft Neuseelands hat im Jahr 2000 weltweit 40-50 solcher Störfälle dokumentiert [1].
Spielen wir in einem Gedankenflug einen solchen Störfall durch. Noch am Boden bei einer Außentemperatur von 15 °C und einem Luftdruck von 1013 Hektopascal (hPa) ertönt folgender Sicherheitshinweis aus den Bordlautsprechern: „Im Falle eines Druckverlustes fallen automatisch Sauerstoffmasken aus der Kabinendecke. In diesem Fall ziehen Sie bitte eine der Masken zu sich heran und drücken Sie die Öffnung fest auf Mund und Nase. Danach assistieren Sie bitte mitreisenden Kindern.“
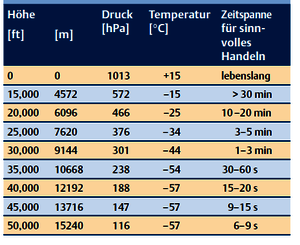
Nach dem Start nimmt während des Steigflugs der Luftdruck mit zunehmender Höhe ab (Tabelle 1). In 2500 m Höhe beträgt der Luftdruck nur noch 735 hPa und auf diesen Wert wird der Druck in der Passagierkabine ab jetzt konstant gehalten, d.h. auf der Reiseflughöhe von 11.000 m herrschen in der Kabine immer noch komfortable 735 hPa, bei einem Außendruck von 220 hPa und einer Außentemperatur von -57 °C.
Lassen wir jetzt den Störfall eintreten: Durch eine Undichtigkeit oder einen anderen technischen Fehler sinkt der Innendruck ab. Automatisch fallen die Sauerstoffmasken aus einer Klappe oberhalb des Sitzplatzes auf uns herunter [2]. (Abb. 2). Im schlimmsten Fall erfolgt ein völliger Druckausgleich mit der Außenatmosphäre und der Kabinendruck sackt auf 220 hPa ab. Das ist für die Passagiere bedrohlich, denn mit jedem Atemzug strömt nur noch 1/5 der benötigten Sauerstoffmenge in die Lunge. Das halten Menschen nicht lange durch, und nach 20-30 Sekunden „useful consciousness“ tritt Bewusstlosigkeit ein (Tabelle 1). Die Passagiere sollten also schnell den vor sich baumelnden „rubber jungle“ greifen, entwirren und im ureigenen Interesse die Sauerstoffmaske aufsetzen. Schaffen sie das, atmen sie soviel Sauerstoff ein wie an der frischen Luft auf Meereshöhe. Damit ist die Gefahr eines Sauerstoffmangels abgewendet!
Wo kommt der Sauerstoff her?
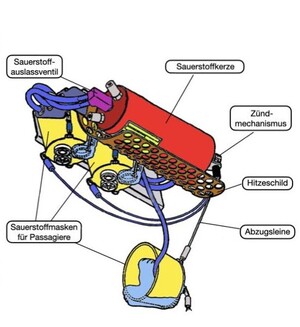
So beruhigt, verfolgen wir neugierig mit unseren Augen den Schlauch nach oben, um herauszufinden, von wo der Sauerstoff kommt. Ein Blick in die offene Klappe verrät uns, die Sauerstoffquelle ist ein Metallzylinder von der Größe einer Thermosflasche (25 cm lang, Durchmesser 7cm) (Abb. 2 oben und Abb. 3) [3]. Dieser als Chemischer Sauerstoffgenerator (chemical oxygen generator) oder treffender als Sauerstoffkerze (oxygen candle) bezeichnete Metallzylinder enthält im Inneren, und das verschlägt uns jetzt die Sprache, etwa ein Kilogramm Natriumchlorat [4]. Und solch ein Ding befindet sich in jeder Sitzreihe über unseren Köpfen. Bei diesem Gedanken dürften selbst hartgesottene Anorganiker unruhig werden!
Aber Geduld, eine kleine chemische Recherche beruhigt: Reines Natriumchlorat ist thermodynamisch stabil, durchaus friedliebend und keineswegs explosiv. Erst im Kontakt mit Reduktionsmitteln (Kohlenstoff, Schwefel, Phosphor und organischen Stoffen) wird es gewalttätig. Reines Natriumchlorat schmilzt unter Schutzgas bei 263 °C und hält sich unverändert in der Schmelze über mehrere Tage [5]. Bei einem zwischenfallfreien Flug geht also keine Gefahr von der Sauerstoffkerze aus, zumal der geschlossene Edelstahlbehälter das Natriumchlorat vor Reduktionsmitteln perfekt schützt.
Chemische Reaktionen über den Köpfen der Passagiere
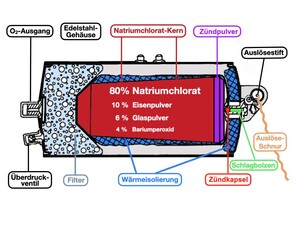
Beim Heranziehen der Sauerstoffmasken hatten wir unbemerkt mit einer Schnur den Auslösestift herausgezogen (Abb. 4). Dadurch wird eine gespannte Feder gelöst und ein Schlagbolzen trifft auf eine Zündkapsel mit einer druckempfindlichen Mischung aus Bleistyphnat und Tetrazen (Abb. 5). Die Zündkapsel explodiert und die dabei freiwerdende Reaktionswärme reicht aus, die benachbarte Schicht des Zündpulvers zur Reaktion zu bringen. Dieses Zündpulver besteht aus einer Natriumchlorat/Eisenpulver-Mischung mit hohem Eisenanteil, die sich in einer stark exothermen Reaktion auf Temperaturen von über 600°C aufheizt.
NaClO3 + Fe → NaCl + FeO + O2 + Wärme (1)
Diese chemische Heizung [6] startet die eigentliche Sauerstoffproduktion im Chloratkern. Natriumchlorat schmilzt und folgende Reaktionen laufen ab [7]:
2 NaClO3 → 2 NaCl + 3 O2 (2)
4 NaClO3 → 3 NaClO4 + NaCl (3)
In einer Folgereaktion zerfällt das gebildete Natriumperchlorat unter Sauerstoffabgabe:
3 NaClO4 → 3 NaCl + 6 O2 (4)
Obwohl der vielstufige Zersetzungsprozess mit den Reaktionsgleichungen (2) bis (4) in geschmolzenem Natriumchlorat im Detail ungeklärt ist, ergibt sich am Ende eine scheinbar einfache Bruttogesamtreaktion:
2 NaClO3 → 2 NaCl + 3O2 + Wärme (5)

Abb. 5.: Initialzünder für den Sauerstoffgenerator. Das Bleisalz der Styphninsäure dient als Initialsprengstoff zum Zünden von Verstärkerladungen. Tetrazen wird dem Bleistyphnat zugemischt, da seine Druckempfindlichkeit die Zuverlässigkeit der Zündkapsel stark erhöht. (Abbildungen: Klaus Roth)
Die Reaktionsstufen 2 bis 4 sind zwar exotherm, aber die dabei freiwerdende Reaktionswärme reicht nicht aus, die Schmelze auf der notwendigen hohen Temperatur zu halten, damit die Sauerstoffbildung weiter abläuft. Die Konsequenz, der „Natriumchlorat-Kern“ würde sich abkühlen und die Sauerstoffproduktion stoppen. Ein Katalysator wäre hilfreich, um die Zersetzungsreaktionen bei tieferen Temperaturen am Laufen zu halten. Einen ersten Katalysator hatte Döbereiner bereits 1832 in Mangandioxid gefunden [8]. In unzähligen Versuchen stellte sich heraus, dass viele Metalle und Metalloxide katalytisch wirken. Die Zersetzungstemperatur konnte zwar gesenkt werden, aber das reichte nicht aus, die Masse kühlte sich immer noch ab und die Reaktion stoppte.
Um die notwendig hohe Temperatur der Mischung zu halten, mischte man dem Chloratkern Eisenpulver bei, dessen Oxidation nach Gleichung (1) auf chemischem Wege genügend Wärme abgab. Mit zugesetztem Glaspulver als Füllmasse kann sowohl die Form des Kerns stabilisiert als auch die Abbrenngeschwindigkeit verlangsamt werden. Durch Ausprobieren lässt sich die optimale Mischung herausfinden, die im Laufe von 15-20 Minuten einen steten Strom von Sauerstoff liefert [9]. Die hohen Temperaturen im Inneren führen zu einer starken Erwärmung der Außenhülle auf über 250 °C. Häufig tritt dann in der Kabine ein leichter Verbrennungsgeruch auf.
Leider laufen bei diesen extremen Reaktionsbedingungen auch unerwünschte Nebenreaktionen ab, etwa die Bildung von elementarem Chlor nach (6)[10].
4 NaClO3 → 2 Na2O + 5 O2 + 2 Cl2 (6)
Da Chlor extrem toxisch für Menschen ist, muss es entfernt werden. Hier fand man mit einer Beimischung von Bariumperoxid, BaO2, eine perfekte Lösung, denn dieses Peroxid fängt bereits in der heißen Schmelze das Chlor ab.
BaO2 + Cl2 → BaCl2 + O2 (7)
Es half das Glück des Tüchtigen, denn Bariumperoxid erwies sich als Katalysator der Natriumchlorat-Zersetzung, erfüllte gleichzeitig zwei Aufgaben, die Katalyse der Bildung und die Reinigung des Sauerstoffs.
Ein verlässliches, sicheres und wartungsarmes Gerät für Notfälle
Insgesamt beruht ein moderner chemischer Sauerstoffgenerator auf vielen Ideen kluger Ingenieure und Naturwissenschaftler. Heute haben wir mit der modernen Sauerstoffkerze ein verlässliches, sicheres und wartungsarmes Gerät für Notfälle bei Sauerstoffmangel in der Hand. Nicht nur für Extrembergsteiger, Feuerwehrleute, U-Boot- und Raumstation-Besatzungen sowie bei Rettungsarbeiten in Bergwerken und Höhlen, sondern für jedermann in Verkehrsflugzeugen und im medizinischen Bereich. Im Laufe dieser schwärmerischen Chemie-Betrachtung dürfte das Flugzeug längst die Flughöhe von 2500m erreicht haben und der Pilot fordert uns zum Ablegen der Sauerstoffmasken auf. Er wird sicherheitshalber auf dem nächsten Flughafen landen, um die Ursachen des Druckverlustes herauszufinden. Was immer der Auslöser gewesen sein mag, wir sind von unserem Gedankenflug sicher gelandet. Natriumchlorat sei Dank!
Der Autor dankt Dr. H.-J. Schugk, Berlin für seine flugtechnische Beratung.
Hinweis:
Dieser Beitrag ist ein Auszug des Artikels „Als Richard Buckleys Hose explodierte“ aus der Chemie in unserer Zeit, 02/2022. Studierende oder Mitarbeitende von Institutionen, die dem DEAL-Abkommen beigetreten sind, können den vollständigen Beitrag unter DOI: 10.1002/ciuz.202100062 lesen. Auch für alle bei der ChiuZ registrierten Schulen ist der Zugriff auf den vollständigen Beitrag freigeschaltet.

Literatur und Anmerkungen
[1] web.archive.org/web/20100525193501/http://www.amsanz.org.nz/avmedia/24/am24_2Decompression.pdf
[2] https://www.youtube.com/watch?v=h20ANJPqEzc; Mit der üblichen Ansage: www.youtube.com/watch?v=6GgsDaNPrck
[3] Einen Überblick geben: www.fzt.haw-hamburg.de/pers/Scholz/materialFS/FS_Skript_12-Sauerstoffanlage.pdf; J. Graf, NASA 2017 Houston TX: https://ntrs.nasa.gov/api/citations/20170002051/downloads/20170002051.pdf
[4] Mit Druckflaschen wird in Verkehrsflugzeugen das Cockpit, mit flüssigem Sauerstoff die Piloten in Kampfjets versorgt. In Verkehrsflugzeugen ist der Chemische Sauerstoffgenerator wegen seines Gewichts und dem geringen Wartungsaufwand die beste Lösung.
[5] Nicht Nachmachen! Bereits Spuren von Verunreinigungen können wirklich verheerende Wirkung haben!
[6] Eine vollständige Oxidation zum Eisen-III-oxid Fe2O3 findet nicht statt, sondern endet beim FeO. W. H. Schechter et al., Ind. Engin. Chemistry, 1950, 42, 2348
[7] M. M. Markowitz et al., J. Phys. Chem., 1964, 68, 2282
[8] J.W. Döbereiner, Ann. Pharm., 1832, 1, 236; vgl. F.E. Brown et al., J. Am. Chem. Soc., 1923, 45, 1343
[9] Wärmebildfilm: www.youtube.com/watch?v=RYDbvVBbHa0; Außenerwärmung: www.youtube.com/watch?v=ru6_66LbWls
[10] J.-G. Liu et al., Int. J. Min. Met. Mat, 2019, 16, 925
[11] International Standard Atmosphere: link.springer.com/content/pdf/10.1007%2F978-3-540-72724-8_7.pdf; M. Wolff, www.theairlinepilots.com/forumarchive/aeromedical/decompressionandhypoxia.php
[12] www.fzt.haw-hamburg.de/pers/Scholz/arbeiten/TextKoehler.



Kommentare
Keine Kommentare gefunden!