Quecksilber – vergöttert und verteufelt

2019 – Jahr des Periodensystems
Quecksilber zählt zu den Elementen, die der Menschheit seit prähistorischer Zeit bekannt sind. Als einziges bei Raumtemperatur flüssiges Metall fasziniert es bis heute jeden, der es zum ersten Mal sieht: die hohe Dichte, die hohe Reflektivität, die Oberflächenspannung – kein Wunder, dass das „lebendige Silber“ verknüpft wurde mit den Göttern (Hermes, dem flinken Götterboten, später seinem römischen Pendant Merkur), mit repräsentativem Reichtum (Quecksilberbassins im antiken Arabien [1], Quecksilberflüsse in China und bei den Azteken) [2,3]), mit einer mystischen Mittlerfunktion zwischen den Welten (zeremonielle Verwendung im antiken Ägypten und bei den Maya sind belegt).[4]
In frühen Zeiten war Quecksilber ein Symbol des ewigen Lebens, im Mittelalter ein zentrales Element der paracelsianischen Lehre. Der flinke, lebendige Mercurius vermittelt zwischen dem Körper (Salz, der Sonne zugeordnet) und dem Geist (Schwefel, dem Mond assoziiert), Abb. 1. [5]. Alle Körper galten als zusammengesetzt aus diesen drei Elementen, auch der Mensch. Störungen des Gleichgewichts, die zu Krankheiten führen, wurden entsprechend behandelt. Daher stammen die ersten pharmakologischen Präparate, wie z. B. unguentum grisum – in Tierfett feinverteiltes Quecksilber, unguentum album – Salbe aus HgNH2Cl, und unguentum luteum – Salbe aus HgO.
Der mystische Aspekt des Quecksilbers ist heutzutage zwar verschwunden, aber bis heute findet Quecksilber Verwendung in der Pharmakologie. Sein Einsatz ist stark zurückgegangen, da man es in fast überall durch ähnlich wirksame Mittel ersetzen konnte (Saatgutbeizung, Hautdesinfektion etc.), aber Thiomersal z. B., der umstrittene Zusatz in manchen Impfstoffen, Kosmetika und Kontaktlinsenflüssigkeiten, ist immer noch unschlagbar in seiner keimtötenden Breitbandwirkung schon bei geringsten Dosen.[6] Mehr zu Quecksilber und seinen Auswirlungen auf den menschlichen Körper im Beitrag Quecksilber – von Alchemisten, roten Wangen und verrückten Hutmachern.

Noch immer viel genutzt
Der Nutzen des Quecksilbers in unserer Zeit umfasst noch viele weitere Bereiche. Die größte Menge wird im Amalgamverfahren eingesetzt, der Elektrolyse einer wässrigen NaCl-Lösung an einer fließenden Hg-Kathode zur Herstellung von NaOH, Cl2 und H2.[7] Das oft schon totgesagte Verfahren sollte längst vom moderneren Membranverfahren abgelöst sein [8] (das bezogen auf eine Tonne Cl2 energieeffizienter ist), bietet aber eine Reihe von Vorteilen, die es vor allem in Mitteleuropa noch am Leben erhalten (z. B. hochkonzentrierte, chloridfreie NaOH, weitgehende Wartungsfreiheit, umfangreiche Adaptierungsmöglichkeiten, z. B. zur Herstellung von Na-Alkoholaten).
Dass Quecksilber im Alltag tatsächlich vielfältig angewendet wird, ist zwar nicht allen Leuten bekannt, aber manchmal wird auch zu Unrecht Quecksilber in Produkten befürchtet. Die Quecksilberthermometer, erkennbar am metallenen Faden, enthalten in Wirklichkeit häufig Galinstan, ein ternäres Eutektikum der Elemente Gallium, Indium und Zinn.[9] Dieses bildet bei Glasbruch ebenfalls charakteristische metallische Kügelchen aus und verbreitet denselben Schrecken. Auch das „Zinnoberrot“ im Malkasten enthält schon lange kein Quecksilbersulfid mehr, sondern organische Farbstoffe.
Weit verbreitet ist Quecksilber hingegen in Leuchtstoff- und Energiesparlampen. Kleinere Mengen sind in Quecksilber-Knopfzellen und in Kippschaltern enthalten. HgTe ist derjenige Halbleiter, der Nachtsichtgeräten und Restlichtverstärkern zugrunde liegt. Größere Mengen Quecksilber finden Anwendung bei der Goldgewinnung und werden dabei in die Umwelt abgegeben. Nischenanwendungen sind Spiegel (Rotationsparaboloide aus flüssigem Quecksilber sind perfekte Spiegeloberflächen), bei porosimetrischen Messungen oder in Spallationsquellen. Quecksilber-Diffusionspumpen sind heute aus den Laboren weitgehend verschwunden, Quecksilber-Gleichrichter sieht man nur noch im Museum.
Quecksilber ist das einzige Metall, das sich recht einfach (durch mehrfache Destillation) in besonders hoher Reinheit herstellen lässt. Das war der Grund, warum Heike Kamerlingh-Onnes seine Untersuchungen zur Leitfähigkeit von Metallen bei tiefen Temperaturen an Quecksilber durchführte, und auch dafür, dass der elektrische Widerstand erstmals über Quecksilber definiert wurde: 1 Ohm wurde auf Vorschlag Werner von Siemens' festgelegt als derjenige Widerstand, den eine Quecksilbersäule von 1 mm² Fläche und 106.30 cm Länge bei 0 °C besitzt.[10]
Wie kam es dazu, dass Quecksilber vom Metall der Götter und der Heilkunde zum Synonym von Gift und Umweltbelastung wurde? Für den größten Imageverfall, den ein chemisches Element je erlitten hat, gibt es ein ziemlich genaues Datum: Im November 1956 wurde in der japanischen Hafenstadt Minamata zum ersten Mal ein neurologisches Krankheitsbild offiziell beschrieben, das in der Folge als „Minamata-Krankheit“ bezeichnet und auf eine chronische Quecksilbervergiftung zurückgeführt wurde.[11] Die Firma Chisso Co. stellte Acetaldehyd aus Ethylen mit dem Katalysator HgSO4 her. Dieser wurde im Prozess teilweise in Methylquecksilbersulfat umgewandelt, ungefiltert über das Abwasser in die Meeresbucht eingeleitet, reicherte sich über die Nahrungskette an und gelangte so auf den Esstisch vieler tausend Anwohner. Erst 1968 wurde die Einleitung der giftigen Abwässer gestoppt. Mehr als dreißigtausend Betroffene und über zweitausend Tote, schwere Langzeitfolgen für Mensch und Natur: eine der größten Umweltkatastrophen mit weitreichenden Folgen für das Verhältnis der Menschheit zu Umweltschutz, zur chemischen Industrie – und schließlich für das Image des Quecksilbers.
Jede lokale Quecksilberemission stellt zugleich ein globales Problem dar, denn das Element wird effizient über die Atmosphäre transportiert. Dabei spielt die Quecksilberquelle so gut wie keine Rolle: Eine ganze Reihe anaerober Mikroorganismen ist in der Lage, beliebige Quecksilberverbindungen in Methylquecksilber-Verbindungen zu metabolisieren.[13] Diese enthalten das Kation [Hg(CH3)]+ und sind selbst schon flüchtig oder werden zu chemisch inertem, wasserunlöslichem, sehr leicht verdampfendem Dimethylquecksilber Hg(CH3)2 weiter methyliert, das schnell in die Atmosphäre gelangt. Dimethylquecksilber ist fettlöslich, hautgängig und passiert sowohl die Blut-Hirn- als auch die Placenta-Schranke. Die resultierenden Vergiftungen sind gravierend und in der Regel tödlich, da kein Gegenmittel bekannt ist. Bereits 0,1 ml über die Haut aufgenommen wirken letal.[13]
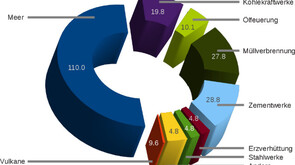
Das Quecksilber in der Erdatmosphäre ist nicht ausschließlich vom Menschen verursacht. Würde man sämtliche humane Emissionen auf Null zurückfahren, wäre das Problem immerhin schon halbiert, aber die natürliche Emission (hauptsächlich aus den Ozeanen) ist in etwa genauso relevant wie die menschengemachte (Abb. 2).[15,16] Der anthropogene Anteil beruht zum Großteil auf Kohle- und Ölverbrennung, Müllverbrennung und der Zementherstellung. Er hat mit der Industrialisierung enorm zugenommen, ist seit den Achtzigern dank verbesserter Filtertechnik aber rückläufig (Abb. 3).[17]

Die Chemie des Quecksilbers
Die Chemie des Quecksilbers ist sehr vielfältig. Es gibt nur wenige Elemente, mit denen Quecksilber keine Verbindungen ausbildet (Abb. 4). Eine Reihe der besonderen Eigenschaften des Quecksilbers lässt sich durch relativistische Effekte erklären: Die hohe Kernladung führt zur Kontraktion der s- und in geringerem Maße auch p-Orbitale, was die Abschirmung für die d- und f-Orbitale erhöht, die dadurch expandieren. So rücken die äußeren Orbitale der Konfiguration [Xe]4f145d106s2 energetisch so weit aufeinander zu, dass das Atom nach außen hin eine außerordentlich stabile, reaktionsträge und edelgasähnliche Elektronenhülle besitzt.
Der tiefe Schmelzpunkt ist eine direkte Folge davon. Darüber hinaus ist Quecksilber das einzige Edelmetall mit endothermer Elektronenaffinität, was für seine Chemie eine große Rolle spielt. Weitere Folgen der einzigartigen Elektronenkonfiguration sind die Ausbildung von [Hgn]2+-Polykationen, insbesondere [Hg2]2+-Dimeren, ein häufig kovalenter Charakter der Hg-Element-Bindungen und die generelle Farblosigkeit vieler Hg-Verbindungen (Ausnahme z. B. Zinnober), die charakteristischen Atom-Emissionslinien im harten UV und die strenge Begrenzung auf die Oxidationsstufen 0, +1 und +2. Zintl-analoge Anionen werden, ganz anders als bei Gold und Platin, nicht ausgebildet. Au– und Pt2– sind isoelektronisch zu Hg0 und besitzen eine analoge edelgas-ähnliche Stabilität.
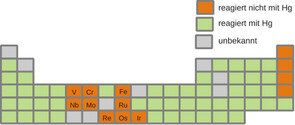
Abb. 4: Quecksilber geht mit den meisten Elementen Verbindungen ein. (Constantin Hoch, LMU München)
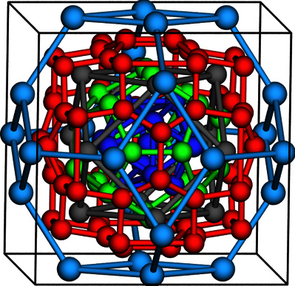
Abb. 5: Das quecksilberreichste aller bekannten Amalgame, Cs2Hg27, kristallisiert in einer einzigartigen kubischen Struktur, die aus konzentrischen Polyedern aufgebaut ist. Nur die äußerste Schale (hellblau) besteht dabei aus Caesiumatomen, darin eingeschlossen ist ein geordneter "Nanotropfen" Quecksilber.[23]
Große Bandbreite von Amalgamen
Auch die intermetallische Chemie des Quecksilbers, die große Familie der Amalgame, ist ausgesprochen vielfältig (Abb. 5 und 6). Die weithin existierende Vorstellung, Amalgame seien einfache homogene Mischungen eines beliebigen Metalls mit Quecksilber, ist nur in ganz wenigen Fällen zutreffend. Die allermeisten Phasendiagramme binärer Amalgam-Systeme zeigen, dass sich definierte Verbindungen mit zumeist kleinen Phasenbreiten ausbilden.
Mit einigen Übergangsmetallen entstehen Hume-Rothery-Phasen, die Bronze und Messing strukturell ähneln. Das berühmteste Amalgam dieses Typs ist Ag2Hg3, das die Hauptphase im Dentalamalgam darstellt und chemisch so unreaktiv ist, dass man es sogar als Mineral Moschellandsbergit in der Natur finden kann. Die einfache Herstellung aus Hg-Metall und Silbernitrat wird zur Entsorgung von Quecksilber („Mercurisorb“) genutzt. Bei den Amalgamen der unedlen Metalle treten ganz andere Strukturen auf und man findet eine einzigartige Vielfalt. Die Elektronegativitätsdifferenz führt zu einem Elektronenübertrag vom unedlen Metall auf Quecksilber, der allerdings aufgrund der endothermen Elektronenaffinität des Edelmetalls unvollständig bleibt.
Der ionische Teilcharakter hängt dabei von der Menge des Quecksilbers in der Verbindung ab: Je größer das Quecksilber-Teilgitter ist, desto effektiver wird auf ihm die negative Ladung delokalisiert. Wenn Quecksilber Elektronen aufnimmt zu Hgδ–, nähert es sich formal dem frühen p-Block an. In Strukturen von Amalgamen mit stark negativ polarisiertem Quecksilber findet man Hg-Teilstrukturen mit entsprechenden Bindungssituationen: p-p-σ-Bindungen führen zu quadratischen [Hg4]δ–-Clustern [18,19] und die Analogie zu den Elektronenmangelverbindungen der Elemente der 3. Hauptgruppe spiegelt sich im häufigen Auftreten von [Hg12]δ–-Ikosaedern wieder.[20,21] Diese Amalgame sind allesamt Metalle, aber schlechte. Sie zeigen sehr hohe spezifische Widerstände und weichen vom linearen Zusammenhang von Temperatur und Widerstand ab. Schon die Kristallstrukturen zeugen vom Zusammenspiel metallischer Strukturmotive (Kugelpackungen) mit ionischen Aspekten (Koordinationspolyeder von Hgδ– um die Kationen), was häufig in extrem komplexen und niedersymmetrischen Strukturen resultiert.
Amalgame unedler Metalle sind Modellverbindungen für die polare Metallbindung im Sinne eines Übergangs von der Metall- zur Ionenbindung. Ein besonders komplexer Vertreter ist das Natriumamalgam, Na11Hg52, das eine gewisse Rolle im Amalgamverfahren spielt: Es ist diejenige feste Phase, die mit flüssigem Quecksilber im Gleichgewicht steht [22] und im Tonnen-Maßstab in der Chlor-Alkali-Elektrolyse hergestellt und wieder zersetzt wird.

Abb. 6: Elektrolytisch hergestellte Kristalle des quecksilberreichen Amalgams Eu10Hg55.[24] Foto: C.Hoch, LMU München
Forschung an Quecksilber und seinen Verbindungen wird immer seltener. Das Image des Elements ist so schlecht, dass selbst Chemiker das Element nicht mehr anfassen mögen. Dabei sind die Risiken im Umgang mit metallischem Quecksilber überschaubar: Arbeitet man unter dem Abzug und stellt eine Wanne unter, die ggf. austretendes Metall auffängt, ist die Gefahr bereits gebannt. Das Element lässt sich leicht recyceln und es fällt kaum Abfall an. Chemiker haben gelernt, mit giftigen Quecksilberverbindungen sicher umzugehen, genauso wie mit Arsen-, Selen-, Nickel- oder Berylliumverbindungen. Das Wissen um den sicheren Umgang mit Quecksilber droht zu verschwinden, weil das Element aus allen Praktika und Experimentalvorlesungen verbannt wird. Die Entsorgung der großen Mengen, die heute noch im Umlauf sind, wird bald zu einer schwierigen Aufgabe.
Literatur
[1] H. E. Fierz-David, Die Entwicklungsgeschichte der Chemie: Eine Studie, 2. Aufl., S. 89, Birkhäuser (Basel), 1952.
[2] Sima Qian, Aus den Aufzeichnungen des Chronisten, Verlag für fremdsprachige Literatur, Beijing, dt. Übers. von G. Kneussel, Bd. 1, S. 59, 2016.
[3] A. Yuhas, Liquid mercury found under Mexican pyramid could lead to king's tomb, The Guardian, 24. April, 2015.
[4] W. Piersig, Die sieben Metalle der Antike: Gold, Silber, Kupfer, Zinn, Blei, Eisen, Quecksilber, GRIN Verlag, München, 2009.
[5] P. Walden (Hrsg.), Theophrast von Hohenheim gen. Paracelsus. Sämtliche Werke, R. Oldenbourg, München, Berlin, 1. Aufl., 1922.
[6] R. C. Rowe, P. J. Sheskey, W. G. Cook, M. E. Fenton (Hrsg.), Handbook of Pharmaceutical Excipients, Pharmaceutical Press, London, 7. Aufl., 2012.
[8] Paris Comission, Reducing atmospheric emissions from existing chlor-alkali plants, PARCOM Decision 90/3, Reykjavik, 1990.
[9] Patent Nr. DE10321843A1, 2003; Patent Nr. EP1477786A1, 2003.
[10] G. Zickner, Zur Einführung des absoluten Ohms, Amtsblatt der Physikalisch-Technischen Bundesanstalt 1950, 2, 70-74.
[11] M. Harada, Crit. Rev. Toxicol. 1995, 25, 1-24.
[12] J. M. Parks, A. Johs, M. Podar, R. Bridou, R. A. Hurt, S. D. Smith, S. J. Tomanicek, Y. Qian, S. D. Brown, C. C. Brandt, A. V. Palumbo, J. C. Smith, J. D. Wall, D. A. Elias, L. Liang, Science 2013, 339, 1332-1335.
[13] Eintrag zu CAS-Nr. 593-74-8 in der GESTIS-Stoffdatenbank des IFA, zuletzt abgerufen am 26.10.2016; OSHA Hazard Information Bulletins, Dimethylmercury, US Department of Labor, 1991.
[14] E. G. Pacyna, J. M. Pacyna, N. Pirrone, D. G. Streets, K. Telmer, Atmospheric Environment 2001, 35, 2987-2996.
[15] F. Slemr, E. Langer, Nature 1992, 355, 434-437.
[16] J. S. Gaffney, N. A. Marley, Energy and Emission Control Technol. 2014, 2, 1-21.
[17] H.-J. Deiseroth, A. Strunck, Angew. Chem. 1987, 99, 701-702; Angew. Chem. Int. Ed. 1987, 26, 687-688.
[18] H.-J. Deiseroth, A. Strunck, Angew. Chem. 1989, 101, 1286-1287; Angew. Chem. Int. Ed. 1989, 28, 1251-1252.
[19] C. Hoch, A. Simon, Z. Anorg. Allg. Chem. 2008, 634, 853-856.
[20] A. Tkachuk, A. Mar, Inorg. Chem. 2008, 47, 1313-1318.
[21] C. Hoch, A. Simon, Angew. Chem. 2012, 124, 3316-3319; Angew. Chem. Int. Ed. 2012, 51, 3262-3265.
[22] C. Hoch, A. Simon, Z. Anorg. Allg. Chem. 2008, 634, 853-856.
[23] F. Tambornino, C. Hoch, Z. Anorg. Allg. Chem. 2015, 641, 537-542.

Das Periodensystem ist ein faszinierendes Ordnungssystem, das die Natur den Elementen gegeben hat. Vor 150 Jahren wurde dieses System erstmals von Wissenschaftlern erkannt. Die Generalversammlung der Vereinten Nationen und die UNESCO haben das Jahr 2019 daher zum International Year of the Periodic Table of Chemical Elements, dem Internationalen Jahr des Periodensystems ausgerufen. Die Elemente des Periodensystems werden in loser Folge vorgestellt.
Bildquelle Titelbild: Bionerd, Pouring liquid mercury bionerd, CC BY 3.0

Kommentare
Keine Kommentare gefunden!