Iod – Das Veilchenfarbene

2019 - Jahr des Periodensystems
Iod bzw. Iodid wird weltweit (wenn auch unbewusst in Form von Seetang oder Tierschilddrüsen) seit über 4000 Jahren zur Kropfbehandlung eingesetzt. Erstmals isoliert wurde das Element erst 1811 von Bernard Courtois als Nebenprodukt bei der Seifenherstellung aus der Asche von Seetang.[1] Zu Courtois großem Ärger zeigten seine Seifensiedekessel starke Korrosionserscheinungen. Bei der Behandlung der Kessel mit Schwefelsäure stieg ein violetter Dampf auf, der in Form von dunklen, glänzenden Kristallen kondensierte (Abb. 1). Da sein Beruf ihm zu wenig Zeit ließ, übergab Courtois seine Arbeiten dem Chemiker Nicolas Clément, der 1813 einen Bericht über die Substanz mit Courtois als Co-Autor veröffentlichte.[2] Das Vorliegen eines chemischen Elements sowie die Analogie zu Chlor erkannte jedoch erst Joseph Louis Gay-Lussac 1814. Er gab dem Iod auch seinen Namen, der sich vom charakteristischen violetten Dampf ableitet („Ioeides“: griech. für veilchenfarben, violett, Abb. 1).

Vorkommen und Eigenschaften
Iod ist (abgesehen von Astat) das seltenste Halogen. Es kommt jedoch in geringen Konzentrationen weit verbreitet in Böden, Gesteinen und Gewässern vor, z. B. als Natriumiodat (NaIO3) oder Lautarit (Ca(IO3)2) im Chilesalpeter oder als Iodid in Solen oder im Meerwasser, wo es von Algen aufgenommen wird. Natürliches Iod besteht zu 100 % aus dem Isotop 127I. Radioaktive Isotope entstehen z. B. durch Kernspaltung und stellen bei Reaktorunfällen eine Gesundheitsgefahr dar, da sie sich in der Schilddrüse anreichern können. Dies lässt sich andererseits auch nutzen: die Isotope 131I (t½ = 8,0 d) und 123I (t½ = 13,2 h) werden als Radiopharmaka in der Schilddrüsentherapie eingesetzt. Iod ist bei Raumtemperatur ein grauschwarzer, metallisch glänzender und halbleitender Feststoff mit einer Dichte von 4,93 g/cm3. Flüssiges Iod (Schmelzpunkt 113,6°C) ist braun und elektrisch leitfähig. Am Siedepunkt (184,2°C) geht es in einen aus I2-Molekülen bestehenden, violetten (veilchenfarbenen) Dampf über (Abb. 1). Allerdings beginnt Iod bereits bei Raumtemperatur zu sublimieren, sodass das Schmelzen unter schneller Temperaturerhöhung erfolgen muss.
Medizinisches
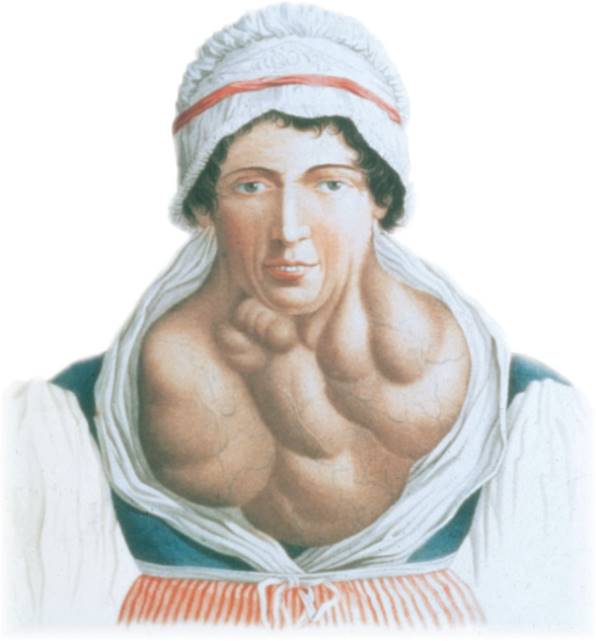
Struma, besser bekannt als Kropf, ist eine tastbare und mitunter sichtbare Vergrößerung der Schilddrüse, die häufig durch Iodmangel ausgelöst wird (Abb. 2). Die Schilddrüse produziert mithilfe von Natriumiodid das Hormon Thyroxin (T4), welches an zwei über Sauerstoff verbrückten Phenolringen je zwei Iodatome enthält. Mithilfe eines Selenoenzyms wird daraus Triiodthyronin (T3), das wirksamste Hormon der Schilddrüse. Beide haben vielfältige Funktionen (z. B. im Nieren-, Nerven- und kardiovaskulären System), kontrollieren den Kohlenhydrat-, Fett- und Proteinstoffwechsel und wirken sich auf die neuronale Entwicklung aus. Iodmangel führt zur verminderten Bildung dieser Schlüsselhormone und damit auch zu zahlreichen gesundheitlichen Beeinträchtigungen, z. B. Entwicklungsstörungen bei Kindern, Leistungsminderung, Übergewicht und Müdigkeit bis hin zu Depressionen bei Erwachsenen. Zur Behandlung eines Iodmangels stehen erprobte Medikamente zur Verfügung, die mit zu den am häufigsten verordneten Medikamenten überhaupt gehören. Problematisch ist aber auch eine Überproduktion von T4, die z. B. bei bestimmten Schilddrüsentumoren aber auch erblich bedingt auftreten kann und zu schweren Herz-Kreislauf-Störungen, Stoffwechselstörungen, Muskelschwund, Osteoporose und Müdigkeit führen kann.[3,4]
Iod wird weiterhin seit über 150 Jahren als Iodtinktur (7 %-ige Lösung mit 3 % KI in Ethanol) oder heute als hautverträglicheres Povidon-Iod (PVPI) zur Wunddesinfektion verwendet. PVPI ist ein Poly(1-(2-oxo-1-pyrrolidinyl)ethylen)iod-Komplex, wobei Iod in Form des Triiodidanions I3 vorliegt. Kürzlich wurde sogar über eine Bandage aus mit PVPI-beschichteten Kohlenstoff-Nanoröhren für die Wundversorgung berichtet.[5] Die desinfizierende bzw. mikrobiozide Wirkung geht von elementarem Iod aus, dessen Oxidationskraft die Proteine der Mikroorganismen denaturiert.
Iod in der Analytischen Chemie
Durch die große Zahl stabiler Oxidationsstufen ist Iod für Redoxtitrationen in der Analytischen Chemie von genereller Bedeutung. Hier stellt die Iodometrie die bedeutendste nasschemische Analysenmethode zur quantitativen Bestimmung reduzierender und oxidierender Analyte dar.[6] Sie beruht auf der Gleichgewichtsreaktion von Iodid-Ionen und elementarem Iod (2I− ⇌ I2 + 2e−). Mittels Iodometrie können sowohl auf I− oxidierend wirkende Analyte (z. B. Cu2+, MnO4−, CrO42−, Cl2, ClO−, ClO3−) als auch auf I2 reduzierend wirkende Analyte (z. B. S2O32−, Sn2+, H2S, HCN) bestimmt werden. Die intensiv blaue Farbe des Iod-Stärke-Komplexes erlaubt zudem eine einfache Erkennung des Äquivalenzpunktes. Weiterhin wird die Iodometrie zur Bestimmung der Anzahl an Doppelbindungen (sogenannte Iodzahl) in langkettigen Alkenen und ungesättigten Fettsäuren verwendet. Iodometrisch bestimmt werden kann auch der Oxidationszustand von Hochtemperatursupraleitern wie YBa2Cu3O7-x, für deren Supraleitung die Anwesenheit geringer Mengen an Cu3+ essentiell ist.[6] Neben der Iodometrie werden die Redoxeigenschaften des Iods auch in weiteren analytischen Verfahren genutzt. So dient in der Iodatometrie die Oxidationskraft von IO3−-Ionen zur quantitativen Bestimmung oxidierbarer Analyte.
Chemie des Iods
Das schwere Iod mit seiner mittleren Elektronegativität (2,2) bietet unter den Halogenen die größte Spielwiese für chemische Verbindungen. Dies kommt schon durch die Fülle und ähnliche Stabilität der Oxidationsstufen (–I bis +VII) zum Ausdruck. Als einziges Halogen liegt Iod in der Natur nicht nur in Oxidationsstufe –I (I–), sondern auch elementar (I2±0) oder als IO3– (z. B. im Chilesalpeter) mit Oxidationsstufe +V vor. Iod bildet mit IF7 das einzige Interhalogen der Oxidationsstufe +VII; I2O5 stellt das stabilste Halogenoxid dar und zerfällt erst über 275 °C in die Elemente. Neben dem diatomaren Element zeigt Iod insgesamt eine ausgeprägte Tendenz zu Element-Element-Bindungen sowohl in Polykationen (z. B. I42+, I5+, I153+) als auch in Polyanionen (z. B. I3–, I7–, I29–). Gerade Polyhalogenide erleben aktuell eine Renaissance durch Synthese in Ionischen Flüssigkeiten (d.h. Salzen mit Schmelzpunkten ≤100°C) als Lösungsmitteln.[7] Erst in diesem Jahr wurden zudem unendliche Polyiodidketten, wie sie für den Iod-Stärke-Komplex schon lange postuliert werden, erstmals strukturell nachgewiesen.[8]
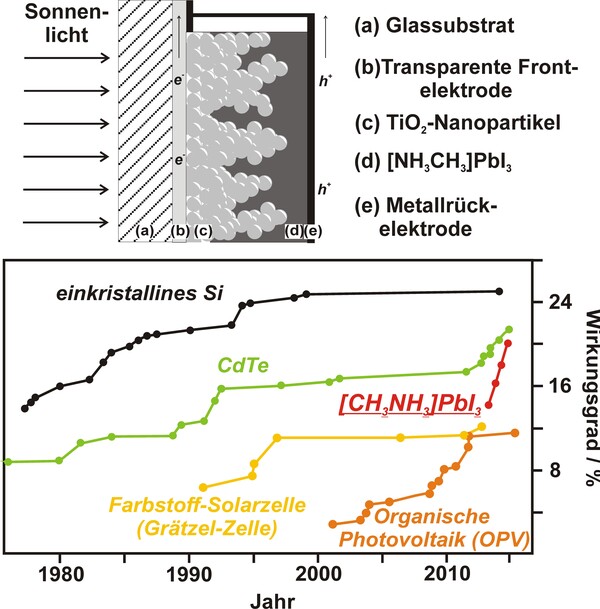
Neben den klassischen Anwendungen von Iod zur Desinfektion, als Transportmittel zur Aufreinigung von Titan im van-Arkel-de-Boer-Verfahren oder der Nutzung von Metalliodiden wie CsI:Tl als Röntgenleuchtstoff, ist der Einsatz von Methylammoniumbleiiodid ([CH3NH3]PbI3) als Lichtabsorber in Solarzellen für die Chemie des Iods bemerkenswert. Obwohl bereits 1978 entdeckt, hat sich die Verbindung erst in den letzten fünf Jahren als echter Glücksfall herausgestellt. [CH3NH3]PbI3 ist ein direkter Halbleiter mit nahezu optimalem Bandabstand (1,55 eV), zeigt ungewöhnlich effiziente Ladungsträgergenerierung unter Lichtabsorption und kann in Lösung (z. B. Dimethylformamid) prozessiert werden (Abb. 3). Schneller als bei jedem anderen Halbleiter zuvor konnten Solarzellen mit Wirkungsgraden von 20-25 % realisiert werden.[9]
Literatur
P. A. Swain, Bull. Hist. Chem. 2005, 24, 103–111.
B. Courtois, N. Clément, C. B. Desormes, Annal. Chim. 1813, 88, 304310.
G. Thews, E. Mutschler, P. Vaupel, Anatomie Physiologie Pathophysiologie des Menschen, 5. Aufl., Wissenschaftliche Verlagsgesellschaft, Stuttgart 1999.
S. Mondal, K. Raja, U. Schweizer, G. Mugesh, Angew. Chem. 2016, 128, 7734–7759; Angew. Chem. Int. Ed. 2016, 54, 12856–12858.
T. J. Simmons, S.-H. Lee, T.-J. Park, D. P. Hashim, P. M. Ajayan, R. J. Linhardt, Carbon 2009, 47, 15611564.
D. C. Harris, Lehrbuch der Quantitativen Analyse, 8. Aufl., Springer, Berlin 2014.
D. Freudenmann, S. Wolf, M. Wolff, C. Feldmann, Angew. Chem. 2011, 123, 11244–11255; Angew. Chem. Int. Ed. 2011, 50, 11050–11060.
S. Madhu, H. A. Evans, V. V. T. Doan-Nguyen, J. G. Labram, G. Wu, M. L. Chabinyc, R. Seshadri, F. Wudl, Angew. Chem. 2016, 128, 8264–8167; Angew. Chem. Int. Ed. 2016, 55, 8032–8035.
M. Grätzel, Nature Mater. 2014, 13, 838–842.


Prof. Dr. Claus Feldmann
Institut für Anorganische Chemie, Karlsruher Institut für Technologie (KIT)
Das Periodensystem ist ein faszinierendes Ordnungssystem, das die Natur den Elementen gegeben hat. Vor 150 Jahren wurde dieses System erstmals von Wissenschaftlern erkannt. Die Generalversammlung der Vereinten Nationen und die UNESCO haben das Jahr 2019 daher zum International Year of the Periodic Table of Chemical Elements, dem Internationalen Jahr des Periodensystems ausgerufen. Die Elemente des Periodensystems werden in loser Folge vorgestellt.
Titelbild: Jasenka/Stock.adobe.com

Kommentare
Keine Kommentare gefunden!