Antimon – unscheinbar und doch allgegenwärtig
2019 - Jahr des Periodensystems
Vorkommen und Eigenschaften
Antimon ist ein silberweißes, glänzendes, sprödes Halbmetall, das in der Natur auch gediegen, d.h. in elementarer Form, gefunden werden kann. Häufiger ist jedoch das Mineral Stibnit (Sb2S3), auch Grauspießglanz oder Antimonit genannt, das auch zur industriellen Gewinnung des Elements dient. Größere Lagerstätten des Stibnits finden sich in China, Mexiko und Bolivien; der weitaus größte Teil des weltweit gehandelten Antimons stammt aus China.
Der Name Antimon leitet sich wahrscheinlich vom lateinischen Antimonium ab, das seinerseits auf das arabische itmid für das Mineral Antimonsulfid zurückgeht. Das Symbol Sb stammt vom lateinischen Stibium, das ebenfalls das Mineral Sb2S3 bezeichnet.

Abbildung 1. Antimon (Foto: Rob Lavinsky, iRocks.com – CC-BY-SA-3.0, Antimony-201382, CC BY-SA 3.0)
Neben der kristallinen, schwarzen Modifikation des Sb2S3 gibt es auch noch eine amorphe, orange Form, die bei der Fällung von Antimonsulfid aus wässriger Lösung entsteht. In besonders beeindruckender Art und Weise geschieht dies im neuseeländischen Thermalgebiet Wai-o-Tapu. Hier dringt heißes, mit Mineralien übersättigtes Wasser aus Spalten im Gestein und bildet an der Oberfläche viele kleine Seen wie z.B. den Champagnerpool (Abbildung 2). An dessen Rand bildet sich eine orange Schicht aus amorphem Sb2S3, während das Wasser durch ausgefallenes Arsensulfid gelb-grün gefärbt ist.

Abbildung 2. Champagnerpool im neuseeländischen Thermalgebiet Wai-o-Tapu (Bildquelle: Chris Counsell, https://www.flickr.com/photos/crispyking/4439815803).
Bekannt ist das Antimon bereits seit dem Altertum. So verwendeten die Menschen in der Bronzezeit Antimon zur Herstellung von Bronzen und im alten Ägypten das schwarze Sb2S3 als Schminke sowie als Bestandteil entzündungshemmender Augensalben.
Verwendung gestern und heute
Im ausgehenden Mittelalter empfahl Paracelsus (1493 – 1541) verschiedenste Antimon enthaltende Rezepturen zur äußeren wie zur inneren Anwendung. So wurde z.B. Kaliumantimonyltartrat, auch bekannt als Brechweinstein, zur Auslösung des Brechreizes eingesetzt (s. auch Beitrag von Carolin Sage hier auf Faszination Chemie). Im 17. Jahrhundert sprach man dem Antimon eine geradezu allheilende Wirkung zu. Der Nürnberger Arzt Hiskias Cardilucius (1630 - 1697) bewarb sein selbst hergestelltes, antimonhaltiges Präparat „Arcana“ als Mittel gegen „innere Stauungen“, Fieber und eine Vielzahl anderer Erkrankungen als Universalarznei. Aufgrund der Giftigkeit praktisch aller Antimonverbindungen sind heute nur noch sehr wenige Antimon enthaltende Medikamente in Gebrauch, die insbesondere zur Behandlung der Tropenkrankheit Leishmaniose zum Einsatz kommen.
Trotz der nur noch geringen Bedeutung des Antimons in der Medizin ist die weltweite Gewinnung des Elements in den letzten zwanzig Jahren stark gestiegen und lag zuletzt bei ca. 200.000 t pro Jahr. Der größte Teil des Antimons wird in Form des Oxids Sb2O3 zusammen mit organischen Halogenverbindungen als Flammschutzadditiv eingesetzt. Es ist daher in vielen alltäglichen Gegenständen wie z.B. Kunststoffgehäusen von Elektrogeräten oder Polstermöbeln zu finden. Antimonoxid alleine ist allerdings kein Flammschutzmittel, sondern verstärkt die flammhemmende Wirkung der eingesetzten halogenierten Verbindungen um ein Vielfaches. Eine geradezu komplementäre Funktion übernimmt das Antimon in Streichhölzern, in deren Zündköpfchen sich Antimon(V)-Sulfid als brennbare Substanz befindet.
Ebenfalls in fast jedem Haushalt zu finden sind wiederbeschreibbare DVDs oder Blue-Ray Disks. Bei diesen Datenträgern kommen Verbindungen zur Anwendung, die unter anderem Antimon enthalten (z.B. Ge2Sb2Te5) und deren Struktur durch Laser-Pulse zwischen einer amorphen und einer kristallinen Phase geschaltet werden können. Die beiden Phasen unterscheiden sich in ihren optischen Eigenschaften und können so zur digitalen Datenspeicherung genutzt werden. [1]
Zusammen mit dem Element Blei bildet Antimon wichtige Legierungen, die noch heute von Bedeutung sind. Wenige Prozent Antimon im Blei erhöhen dessen Härte und verbessern das Gussverhalten durch geringere Kontraktion beim Erstarren. So enthalten beispielsweise die Bleiplatten in Autobatterien stets kleine Mengen von Antimon. Auf die Eigenschaft des Antimons, sich beim Abkühlen auszudehnen, ist auch zurückzuführen, dass seine Legierungen im industriellen Präzisionsguss verwendet werden. Komplizierte Gießformen können so vollständig ausgefüllt werden, da sich die Legierung beim Erstarren in alle Ecken und Winkel presst.
Auch Lettern für den Buchdruck bestehen aus Antimonlegierungen, dem sogenannten Letternmetall, welches aus Blei mit 5 bis 6 % Zinn und ca. 28% Antimon und mitunter auch etwas Kupfer zusammengesetzt ist. Diese Legierung verwendete bereits Johannes Gutenberg im 15. Jahrhundert für seine Lettern und setzte sie in der ersten von ihm entwickelten Druckerpresse ein. Heute ist der klassische Buchdruck mit Lettern jedoch weitgehend durch den Offsetdruck abgelöst.
Obgleich Legierungen der Elemente Blei und Antimon also schon eine lange Tradition haben, waren molekulare Verbindungen, die chemische Bindungen zwischen beiden Elementen aufweisen, lange Zeit unbekannt. Eines der ersten Beispiele dieser Substanzklasse stellt die Blei-Antimon-Käfigverbindung [Pb4(SbR)6] (R = SiiPr3) dar, deren Molekülstruktur in Abbildung 3 gezeigt ist. [2]
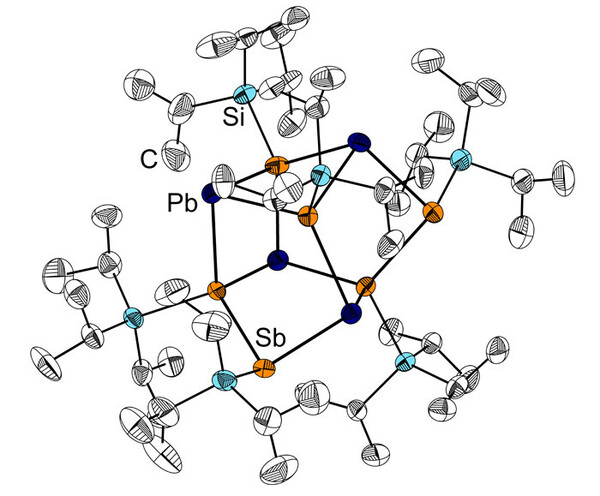
Abbildung 3. Molekülstruktur der Blei-Antimonverbindung [Pb4(SbSiiPr3)6] im Kristall (Carsten von Hänisch, Uni Marburg).
Seit dem Verbot von Asbest in Bremsbelägen wird heutzutage häufig Antimonsulfid als Schmiermittel eingesetzt, um ein möglichst ruckelfreies Bremsen zu ermöglichen. Durch den unvermeidlichen Abrieb beim Bremsen führt dies jedoch insbesondere im städtischen Bereich zu einer starken Zunahme von antimonhaltigem Feinstaub. Inwieweit diese Belastung mit Antimon die Gesundheit der Anwohner gefährdet, ist noch umstritten. Dennoch haben einige Hersteller bereits auf antimonfreie Bremsbeläge umgestellt.
Vom Lewis-sauren SbF5 zur magischen Säure
Eine der wohl wichtigsten Antimonverbindungen sowohl in der Forschung als auch in der (Petro-) Chemischen Industrie ist das Antimon(V)-Fluorid (SbF5). Aufgrund seiner starken Lewis-Acidität (die Fluoridionenaffinität von SbF5 in der Gasphase beträgt 489 kJ/mol) bildet es zusammen mit den Brønsted-Säuren HF oder FSO3H die extrem sauren Spezies HF-SbF5 bzw. FSO3HSbF5 (Magische Säure). Diese Verbindungen sind unter anderem in der Lage, Paraffine zu zersetzen und sehr schwache Basen, wie beispielsweise CH4, zu protonieren. Der Name „Magische Säure“ geht auf einen deutschen Post-Doktoranden in der Arbeitsgruppe von Georg A. Olah zurück, der auf einer Weihnachtsfeier ein Stück Kerzenwachs in ein FSO3H/SbF5-Gemisch warf und zu seiner Verblüffung feststellte, dass es sich auflöste. NMR-spektroskopische Untersuchungen zeigten anschließend, dass das Kerzenwachs unter Bildung von tertiär-Butyl-Kationen zersetzt wurde. Diese Entdeckung hatte eine intensive Forschung zu Carbenium- und Carboniumionen zur Folge, die 1994 mit dem Nobelpreis für Olah gewürdigt wurde. [3]
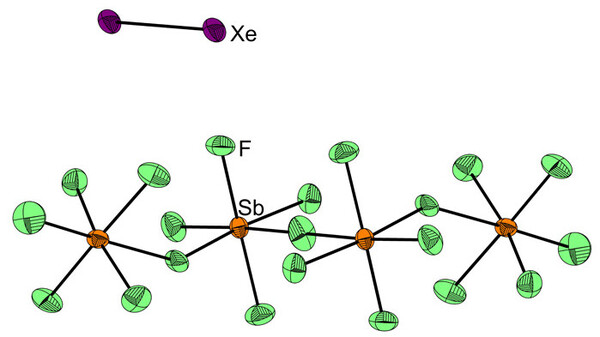
Die Chemie dieser supersauren Gemische hat auch auf einem ganz anderen Gebiet der Forschung, nämlich der Edelgaschemie, zu spektakulären neuen Entdeckungen geführt. So konnte aus einem Gemisch von XeF+ Sb2F11-, SbF5 und wasserfreier HF unter Xenonatmosphäre die erste Verbindung mit einer Xenon-Xenon-Bindung erhalten werden, die zugleich das bisher größte Antimon(V)-Fluorid-basierte Anion aufweist. Bei -30°C kristallisiert aus diesem Reaktionsgemisch die Verbindung Xe2+ Sb4F21- aus (siehe Abbildung 4). [4] Auch Verbindungen, in denen Xenon-Atome als Liganden an Gold- bzw. Quecksilberionen koordinieren, konnten nur durch Verwendung dieser supersauren Reaktionsmedien erhalten werden. [5]
W. Bensch, M. Wuttig, Chem. Unserer Zeit, 2010, 44, 92-107.
S. Traut, C. von Hänisch, Chem. Commun., 2010, 46, 1538-1540.
G. A. Olah, Angew. Chem., 1973, 85, 183-234.
T. Drews, K. Seppelt, Angew. Chem., 1997, 109, 264-266.
a) S. Seidel, K. Seppelt, Science, 2000, 290, 117-118; b) T. Drews, S. Seidel, K. Seppelt, Angew. Chem., 2002, 114, 470-473; c) I.-C. Hwang, S. Seidel, K. Seppelt, Angew. Chem., 2003, 115, 4528-4531.

Prof. Dr. Carsten von Hänisch
Fachbereich Chemie und Wissenschaftliches Zentrum für Materialwissenschaften Philipps-Universität Marburg
Das Periodensystem ist ein faszinierendes Ordnungssystem, das die Natur den Elementen gegeben hat. Vor 150 Jahren wurde dieses System erstmals von Wissenschaftlern erkannt. Die Generalversammlung der Vereinten Nationen und die UNESCO haben das Jahr 2019 daher zum International Year of the Periodic Table of Chemical Elements, dem Internationalen Jahr des Periodensystems ausgerufen. Die Elemente des Periodensystems werden in loser Folge vorgestellt.
Dieser Beitrag wurde auf FaszinationChemie erstmalig veröffentlicht am 19.03.2019


Kommentare
Tjark Neimöck
am 05.06.2021Bjoern
am 29.09.2024Reesolini
am 14.11.2024