Technetium – Ein künstliches Element macht Karriere im Krankenhaus
2019 – Jahr des Periodensystems
Zwar hatte Dmitry Mendelejev bereits 1871 in seinem Periodensystem der Elemente zwei Plätze für die schweren Homologen des Mangans reserviert, [1] doch die Suche nach den von ihm Eka-Mangan (Em) und Tri-Mangan (Tm) genannten Elementen gestaltete sich schwierig und konfliktreich. [2] Das letztere Element, heute Rhenium genannt, wurde von Ida Tacke und Walther Noddack zwar 1925 erstmals röntgenspektroskopisch nachgewiesen und drei Jahre später auch in wägbaren Mengen isoliert. [3] Die in der gleichen Arbeit reklamierte Entdeckung des Eka-Mangans, von Tacke und Noddack „Masurium“ genannt, konnte jedoch weder von ihnen reproduziert, noch von anderen Gruppen bestätigt werden. Erst im Jahr 1937 gelang es, aus einem mit Deuteronen beschossenen Molybdänblech Spuren des lange gesuchten Eka-Mangans anzureichern und zweifelsfrei nachzuweisen. [4] Es gereicht den italienischen Entdeckern Emilio Segré und Carlo Perrier zur Ehre, allen nationalistischen Zwängen ihrer Zeit widerstanden zu haben und das neue Element nicht „Panormium“ (nach Palermo), „Sicilium“ (nach Sizilien) oder gar „Faschismium“ genannt zu haben. Ihrem Vorschlag folgend, erhielt das Element Nr. 43 im Jahr 1947 den Namen Technetium (nach griech. τεχνητός, „künstlich“) [5], denn es war tatsächlich das erste chemische Element, das zuerst von Menschenhand hergestellt wurde, bevor es in natürlichen Quellen nachgewiesen werden konnte.
Irdische Vorkommen
Die natürlichen Quellen für Technetium sind mehr als begrenzt. Da keine stabilen Technetiumisotope existieren und das längstlebige Isotop 98Tc eine Halbwertszeit von „nur“ 4,2 Mio. Jahren besitzt, sind primordiale Vorkommen auszuschließen. Mit der Spontanspaltung von 238U (ein neben der Alpha-Strahlung zweiter, wenn auch mit einem prozentualen Anteil von 5,45*10-5 % extrem seltener Zerfallspfad für dieses Radioisotop) existiert allerdings ein natürlicher Prozess, in dem Spurenmengen an Zerfallsprodukten und damit eben auch Technetium in Uranerzen ständig nachgebildet werden. 1961 gelang es B. T. Kenna und P. K. Kuroda, aus mehreren Kilogramm Pechblende etwa ein Nanogramm Technetium zu isolieren. [6]
Das Entstehen von Technetiumspuren durch den Spontanzerfall von Uran gab in den vergangenen Jahrzehnten immer wieder Anlass, die Möglichkeit einer Entdeckung des Elementes in den zwanziger Jahren des vorigen Jahrhunderts durch Tacke und Noddack neu zu diskutieren. Trotz einer umfassenden und sehr sorgfältigen Bewertung all dieser Argumente durch G. Herrmann mit dem abschließenden Statement, dass es keinerlei Anhaltspunkte gibt, die Entdeckungsgeschichte des Elementes 43 zu revidieren [7], finden sich immer wieder einmal Artikel von Anhängern des „Masuriums“.
Heute ist Technetium keineswegs ein seltenes Element. Die Spaltung eines Kilogramms 235U in einem Kernreaktor liefert knapp 30 g Technetium. Das entspricht einer Spaltausbeute von etwa 6 Prozent und in der Summe haben wir es mittlerweile mit mehreren hundert Tonnen Technetium auf unserem Planeten zu tun. Die größte Menge davon befindet sich in abgebrannten Kernbrennstäben oder wurde während der Wiederaufarbeitungsprozeduren abgetrennt. Durch Kernwaffenversuche in der Atmosphäre und durch unausgereifte technologische Prozesse in der Frühzeit der Wiederaufarbeitung gelangte jedoch auch eine erhebliche Menge (man schätzt mehrere Tonnen) an 99Tc in die Umwelt. Diese befinden sich zumeist im Meerwasser und stellen kein nennenswertes radiologisches Risiko dar.
Isotope und Isotopengenerator
Technetiumisotope existieren mit Massenzahlen zwischen 85 und 118. 98Tc besitzt mit 4,2*106 Jahren davon die längste Halbwertszeit. Von praktischer Bedeutung sind derzeit jedoch nur das bei der Kernspaltung in den angesprochenen relativ großen Mengen entstehende Isotop 99Tc und sein metastabiles Kernisomeres 99mTc. Kernisomere sind Kerne in einem angeregten, also energiereichen Zustand. Die überschüssige Energie wird in der Regel in Form von Gammastrahlung abgegeben. Verfügt solch ein angeregter Kern über eine Halbwertszeit von mehr als 10-9 s, wird er als metastabil bezeichnet. Die Halbwertszeit von 99mTc ist mit 6,01 h deutlich länger. Deswegen kann dieses Nuklid bequem von seinem Mutterisotop 99Mo abgetrennt werden und als praktisch reiner Gammastrahler in der nuklearmedizinischen Diagnostik verwendet werden (Abb. 1).
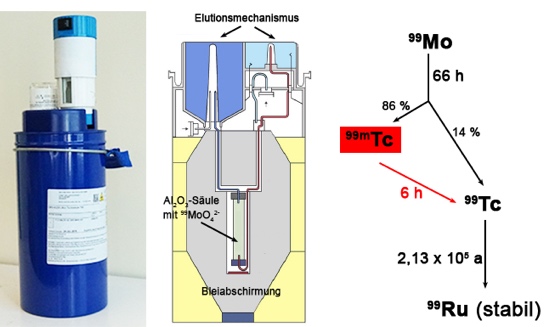
Abb. 1: Gewinnung von 99mTc in einem handelsüblichen 99Mo/99mTc-Generator (Ulrich Abram, FU Berlin)
Die Abtrennung von 99mTc geschieht in der Praxis meist in sogenannten 99Mo/99mTc-Nuklidgeneratoren, in denen 99MoO42- auf einer Al2O3-Säule fixiert wird und zu 99mTcO4- zerfällt. Das einfach geladene Pertechnetat-Anion kann von dort mit isotonischer Kochsalzlösung heruntergespült werden und steht in dieser Form für medizinische Anwendungen bereit. Dazu ist es notwendig, Komplexverbindungen zu erzeugen, die das radioaktive Metall-Ion in den gewünschten Organen und Organsystemen anreichern.
Technetium und seine Verbindungen
Technetium ist ein silbergraues Metall (Abb. 2), das sich in oxidierenden Säuren leicht auflöst. Stabile Oxide sind das schwarz-braune TcO2 und das schwach gelbe Tc2O7, das anders als die analoge Rheniumverbindung eine molekulare Struktur besitzt. [8] Von den binären Halogeniden des Technetiums waren lange Zeit nur TcCl4, TcF5 und TcF6 strukturell eindeutig bestimmt. In den letzten Jahren ist es aber der Gruppe um F. Poineau gelungen, TcBr4, TcBr3, α,β-TcCl3, α,β-TcCl2 und TcI3 zu isolieren und strukturell zu charakterisieren. [9]

Abb. 2: a) Elementares Technetium und b) TcCl4. (Ulrich Abram, FU Berlin)
Als Element der 7. Gruppe des Periodensystems verfügt Technetium über eine vielfältige Koordinationschemie. Es existieren Technetiumkomplexe von nahezu allen bekannten Ligandsystemen. Dazu stehen acht Oxidationsstufen zur Verfügung und Tc-Komplexe sind mit Koordinationszahlen zwischen 4 und 9 bekannt. Eine Auswahl davon ist in Abb. 3 zu sehen.
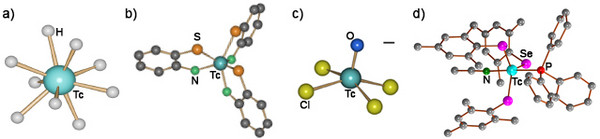
Abb. 3: Typische Koordinationsverbindungen des Technetiums: a) [TcVIIH9]2-, trigonal-prismatisches [TcVI(Aminobenzenthiolat)3], c) quadratisch-pyramidales [TcVOCl4]- und d) trigonal-bipyramidales [TcIII(SeMes)3(PPh3)(CH3CN)]. (Ulrich Abram, FU Berlin)
Organotechnetiumverbindungen fanden lange Zeit wenig Beachtung. Das änderte sich nach der Entdeckung der Myocardaffinität kationischer Isonitrilkomplexe (siehe dazu auch Abb. 6c) und insbesondere nach der Erschließung von Tricarbonyltechnetium(I)-Verbindungen über eine Normaldrucksynthese durch R. Alberto. [10] Mit dem Zugang zu [99mTc(CO)3(H2O)3]+ wurde auch die Tür für eine breite Erforschung neuer Nuklearpharmaka auf der Basis von Organotechnetiumverbindungen weit geöffnet und neue Forschungsergebnisse auf diesem Gebiet werden praktisch monatlich publiziert. Neben den Tricarbonylkomplexen fanden in letzter Zeit auch Tc-Komplexe mit N-heterocyclischen Carbenen und Cyclopentadienyl-Liganden Beachtung (Abb. 4).
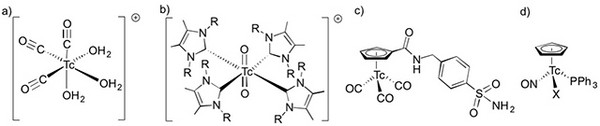
Abb. 4: Typische Organotechnetium-Verbindungen [10-13]. (Ulrich Abram, FU Berlin)
Die große Vielfalt der zugänglichen Technetiumkomplexe ist zugleich eine Herausforderung und eine Chance, wenn es um die Entwicklung geeigneter Verbindungen für die Nuklearmedizin geht. Einerseits steht ein nahezu unbegrenztes Arsenal an möglichen Kandidaten zur Verfügung, andererseits müssen entsprechend robuste Synthesewege gefunden werden, die die Zielverbindungen auch in Eintopfreaktionen mit großer Reinheit liefern.
Abb. 4.a: Injektion von 99mTc. Die Spritze mit dem Radionuklid ist von einer Abschirmung umgeben. (Bildnachweis: Bionerd, Tc99minjektion, CC BY-SA 3.0)
Anwendungen in der Medizin
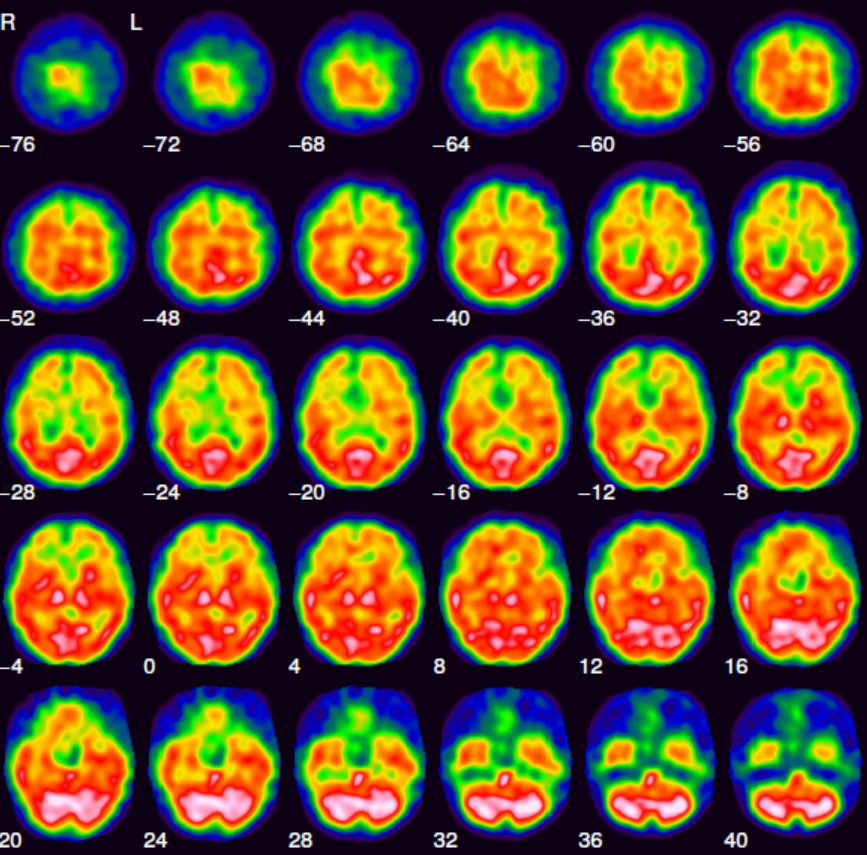
Das über 99Mo/99mTc-Generatoren (Abb. 1) im klinischen Alltag nahezu unbegrenzt und zu jeder Zeit zur Verfügung stehende metastabile Kernisomere 99mTc besitzt als praktisch reiner Gammastrahler mit einer Energie von 140 keV und einer Halbwertszeit von 6 h ideale Eigenschaften für ein diagnostisches Radionuklid. Dazu kommt, dass die eingesetzten Technetiumverbindungen in etwa nanomolaren Konzentrationen vorliegen und damit klassische Toxizitätsprobleme bei der Verwendung von Schwermetall-Ionen in der Medizin keine Rolle spielen. Gegenwärtig werden trotz aller Anstrengungen, 99mTc durch Positronenstrahler (etwa 68Ga) zu ersetzen, immer noch um die 80 Prozent aller Routineuntersuchungen in der nuklearmedizinischen Diagnostik mit 99mTc durchgeführt. Ein Beispiel für eine solche Aufnahme ist in Abb.5 gezeigt.
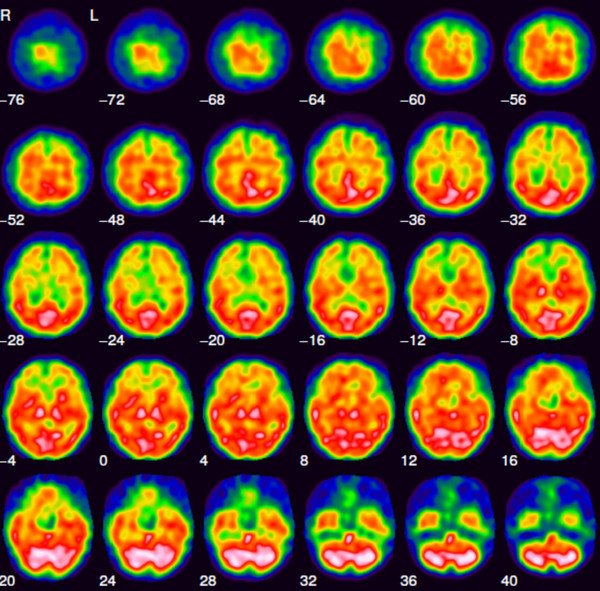
Abb. 5: Schnittaufnahmen durch ein menschliches Hirn. Das Bild wurde mit 99mTc-HMPAO, der Verbindung b) in Abb. 6, aufgenommen. (Bildquelle: Winfried Brenner, Charite Berlin)
Aus koordinationschemischer Sicht werden neben Tc(IV)-Komplexen mit DTPA oder derivatisierten Komplexon- oder Phosphonat-Liganden für die klassische Nieren-, Leber- oder Skelettszintigraphie auch quadratisch-pyramidale Oxidotechnetium(V)-Verbindungen für die Untersuchung der Hirnperfusion oder der Nierenfiltrationsrate verwendet. Eines der umsatzstärksten Tc-Radiopharmaka ist der schon weiter oben angesprochene kationische Tc(I)-Komplex mit sechs Isonitril-Liganden zur Untersuchung der Durchblutung des Herzmuskels (Abb. 6).
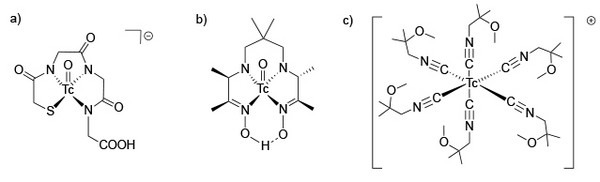
Abb. 6: Moderne, nuklearmedizinisch genutzte Technetiumverbindungen: a) TcO-MAG3 zur Nierenszintigraphie, b) Tc-HMPAO zur Hirnszintigraphie und c) Tc-Sestamibi zur Myocardszintigraphie. (Ulrich Abram, FU Berlin)
Kurioses und Wissenswertes
Auch wenn alles 99Tc, das in dem natürlichen Kernreaktor von Oklo im heutigen Gabun durch Uranspaltung entstanden ist, selbst längst zerfallen ist (man geht von einem Ereignis aus, das vor ca. 1,7 Mrd. Jahren stattgefunden hat), hat es doch seine Signatur in Form seines Zerfallsproduktes, des stabilen 99Ru, und des Isotops 100Ru als Folge eines Neutroneneinfangs des damals existierenden 99Tc dort hinterlassen und ist somit ein Kronzeuge für die Erklärung des sogenannten Oklo-Phänomens. [14]
Der Nachweis von Technetiumlinien in den Spektren sogenannter „Roter Riesen“ gilt als Beweis dafür, dass auch schwerere Elemente als Eisen durch die stellare Nukleosynthese hergestellt werden können. [15] In leichteren und jüngeren Sternen wie unserer Sonne läuft dieser Prozess hingegen nicht ab. Eine kuriose Eigenschaft weisen wässrige Lösungen von Kaliumpertechnetat auf. Sie verhindern die Korrosion von Stahl bereits in geringsten Konzentrationen. [16] Eine befriedigende Erklärung für dieses Verhalten konnte bislang noch nicht gegeben werden, an eine praktische Anwendung im großen Umfang ist wegen der Radioaktivität des Technetiums freilich ohnehin nicht zu denken.
D. Mendelejev, Annalen der Chemie und Pharmacie, Suppl. 8(2) (1871) 133.
E. Scerri, A Tale of Seven Elements, Oxford University Press, 2013.
W. Noddack, I. Tacke, O. Berg, Sitzungsber. Berl. Akad. d. Wiss., Phys.-mathem. Kl. (1925) 400; W. Noddack, I. Tacke, O. Berg, Die Naturwissenschaften 13 (1925) 567; I. Tacke, W. Tacke, Z. anorg. allg. Chem. 183 (1929) 353.
C. Perrier, E. Segre, J. Chem. Phys. 5 (1937) 712.
C. Perrier, E. Segre, Nature 159 (1947) 24.
P. T. Kenna, P.K. Kuroda, J. Inorg. Nucl. Chem. 23 (1961) 142; P. T. Kenna, P. K. Kuroda, J. Inorg. Nucl. Chem. 26 (1964) 493.
G. Herrmann, Nucl. Phys. A505 (1989) 352.
B. Krebs, Angew. Chem. 81 (1969) 328.
F. Poineau, E. V. Johnstone, K. R. Czerwinski, A. P. Sattelberger, Acc. Chem. Res. 47 (2014) 624.
R. Alberto, R. Schibli, A. Egli, P. A. Schubiger, U. Abram, T. A. Kaden, J. Am. Chem. Soc. 120 (1998) 7987; R. Alberto, R. Schibli, R. Waibel, U. Abram, A. P. Schubiger, Coord. Chem. Rev. 190-192 (1999) 901.
H. Braband, T. I. Zahn, U. Abram, Inorg. Chem. 42 (2003) 6160.
D. Can, B. Spingler, P. Schmutz, F. Mendes, P. Raposinho,C. Fernandes, F. Carta, A. Innocenti, I. Santos, C. T. Supuran, R. Alberto, Angew. Chem. 51 (2012) 3354.
J. Ackermann, A. Hagenbach. U. Abram, Chem. Commun. 52 (2016) 10285.
P. K. Kuroda, Naturwissenschaften, 70 (1983) 536.
S. Paul, W. Merrill, Astrophys. J. 116 (1952) 21.
D. H. Cartledge, J. Phys. Chem. 59 (1955) 979.

Prof. Ulrich Abram
Institut für Chemie und Biochemie, Freie Universität Berlin
Das Periodensystem ist ein faszinierendes Ordnungssystem, das die Natur den Elementen gegeben hat. Vor 150 Jahren wurde dieses System erstmals von Wissenschaftlern erkannt. Die Generalversammlung der Vereinten Nationen und die UNESCO haben das Jahr 2019 daher zum International Year of the Periodic Table of Chemical Elements, dem Internationalen Jahr des Periodensystems ausgerufen. Die Elemente des Periodensystems werden in loser Folge vorgestellt.

Kommentare
Gudi
am 28.02.2021