Xenon und weitere Edelgase – die fehlenden Bausteine im Periodensystem

2019 – Jahr des Periodensystems
Das Edelgas Argon wurde 1895 in der Luft nachgewiesen, die Entdeckung der anderen Edelgase Helium, Neon, Krypton, Xenon und des radioaktiven Radon erfolgte kurz darauf. Damit hatte das Periodensystem der Elemente seine perfekte Form erhalten, da die unreaktiven Edelgase die extrem elektropositiven Alkalimetalle von den extrem elektronegativen Halogenen trennen. Die Vorkommen der Edelgase sind außer beim Radon auch bei Helium und Argon das Ergebnis fortlaufender, radioaktiver Zerfallsprozesse: Helium ist das Produkt der alpha-Radioaktivität der drei natürlichen Zerfallsreihen, hat sich im Erdmantel angereichert und findet sich damit im Erdgas. Argon entsteht aus 40Kalium durch K-Einfang und findet sich damit so viel mehr in der Atmosphäre als die anderen Edelgase.
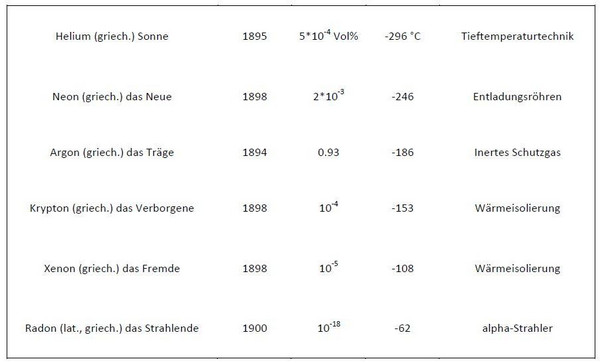
Die Edelgase, Namensgebung, das Jahr ihrer Entdeckung, Häufigkeit in Luft, Siedepunkt und vorwiegende Verwendung
Immer wieder tauchte die Frage auf, ob die Edelgase wirklich gänzlich unreaktiv seien. Aber die Geburt der Edelgasverbindungen war schwierig. Um im Bild zu bleiben, hat es zunächst mehrere Fehlgeburten gegeben. Bereits 1933 waren D. M. Jost und A.K. Kaye ganz nahe dran, weil sie die Reaktion von Xenon mit elementarem Fluor probierten. Eigentlich hätte das klappen müssen, der Grund für den Fehlschlag ist bis heute unklar. Linus Pauling hat Jahrzehnte lang daran festgehalten, dass es Edelgasverbindungen geben müsse, z. B. ArO4 (vergl. ClO4-). Erst 1961 gab er die Hoffnung auf. Aber nur ein Jahr später gelang Neil Bartlett die Reaktion von Xenon mit Platinhexafluorid. [1] Auch dies war kein glückliches Kind, denn bis heute ist die genaue Natur des primären Produkts Xe(PtF6)n nicht bekannt, auch der Reaktionsmechanismus blieb bis heute unklar. Aber es war der Startschuss, nur wenig später publizierte Rudolf Hoppe das XeF2, XeF4 folgte bald darauf, hergestellt in den Argonne National Laboratories (USA).
Nach mehr als einem halben Jahrhundert stellt sich die Edelgaschemie so dar: Bis auf XeF2, XeF4, XeF6 und XeO64- sind alle anderen Edelgasverbindungen instabil. Die Herausforderung war und ist, neue Verbindungen unter Tieftemperaturbedingungen, fast immer in fluorresistenten Gefäßen unter Ausschluss von Feuchtigkeit herzustellen. Zunächst war die Edelgaschemie eine reine Hauptgruppenchemie. Xenon bindet außer an Fluor an Sauerstoff und verschiedene Sauerstoff-, Stickstoff- und Kohlenstoffliganden. Die Mehrheit dieser Verbindungen leitet sich vom zweiwertigen Xenon ab, vier-, sechs- und achtwertige Xenonverbindungen sind, in dieser Reihenfolge, seltener. Oft sind die zu Grunde liegenden Reaktionen nukleophile Substitionen an den wenigen binären Startverbindungen. Fortschritte auf diesem Gebiet setzt die Synthese und Handhabung immer empfindlicherer Verbindungen unter zunehmend extremen Bedingungen voraus. Die jüngste Verbindung dieser Art enthält das Kation Xe-O-Xe2+.[2]. Die Edelgaschemie ist fast ausschließlich eine Xenonchemie. Die einzige binäre Verbindung des Krypton ist KrF2. Kr(OTeF5)2 ist nachgewiesen worden, konnte aber nicht isoliert werden. Das Kation KrF+ bindet in Salzen auch an stickstoffhaltige Gruppen. Überhaupt nur in Matrix unterhalb 30 K konnte ein HArF nachgewiesen werden. Die Chemie des Radon ist wegen seiner kurzen Halbwertzeit (längstlebiges Isotop: 222Rn 3.8 Tage) weitgehend unbekannt. Helium und Neon bilden offenbar überhaupt keine Verbindungen.
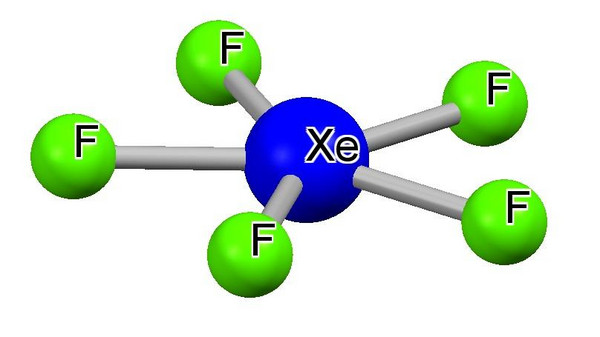
Abb.1. zeigt das Anion XeF5- in der Verbindung (CH3)4N+ XeF5-, ein Derivat des XeF4 , hat die in der Chemie seltene Form eines regelmäßigen Fünfecks. (Konrad Seppelt, FU Berlin, nach [2])
Fast alle dieser Verbindungen sind strukturell einfach zu beschreiben, sie gehorchen den Regeln des VSEPR Models: z.B. sind XeF2 und seine Derivate linear aufgebaut, XeF4 und seine Derivate sind quadratisch, XeO4 dagegen tetraedrisch aufgebaut. Eine berühmte Ausnahme ist die Struktur des XeF6. Nach dem obengenannten Modell sollte dieses nicht oktaedrisch sein. Nach Dutzenden von Untersuchungen, experimentellen wie theoretischen, wird es am besten als ein geringfügig dynamisch verzerrtes Oktaedermolekül beschrieben. In kondensierter Phase assoziiert es vorwiegend zu einem Tetramer, auch Trimere und Oktamere sind nachgewiesen worden.
Die Suche nach Xenonverbindungen in anderen Bindungszuständen war lange Zeit wenig erfolgreich, allerdings gab es frühzeitig schon Hinweise: Bei Reduktion von XeF2 in SbF5/HF Lösung, in der es als XeF+ vorliegt, entsteht eine grüne Lösung, in der richtigerweise das Xe-Xe+ Kation vermutet wurde, wie es Jahrzehnte später durch die Kristallstrukturanalyse des Xe2+ Sb4F21- bewiesen werden konnte, mit einer sehr langen Bindung (308 pm) zwischen den Xenonatomen. Unter höherem Xenondruck bei Raumtemperatur bildet sich in Lösung sogar ein blaues, linear aufgebautes Xe4+ Kation. Allerdings sind in diesem Fall die Xe-Xe Bindungen als noch schwächer anzunehmen.[3].
Auch die Idee, Xenon als Ligand in Übergangsmetallkomplexen zu binden, stand schon länger zur Diskussion. Spektroskopische Hinweise gab es bereits. Doch war es eine Überraschung, als Xenonkomplexe in ein-, zwei- und dreiwertigen Goldverbindungen mit erstaunlicher Stabilität isoliert werden konnten, bis hin zu AuXe42+.[4] Auch ein HgXe2+ Ion konnte isoliert werden. Diese wenigen Xenonkomplexe sind die einzigen geblieben. Die Frage, warum dies so ist, ist bis heute nicht beantwortet worden. Nach qualitativen Überlegungen und Rechnungen sollte es eigentlich weitere geben, wenn die Metallatome kationisch vorliegen, und es sich wegen des relativistischen Effektes, der die Bindung zwischen Xenon und Metallatom offenbar verstärkt, vornehmlich um schwere Übergangsmetalle als Bindungspartner handelt.
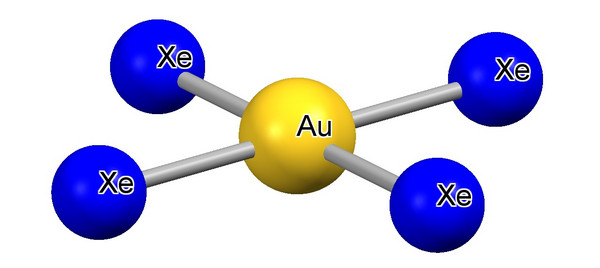
Abb. 2. zeigt das Kation AuXe42+in der Verbindung AuXe42+ (Sb2F11-)2. (Konrad Seppelt, FU Berlin)
Die Zahl aller Edelgasverbindungen dürfte in der Größenordnung von Hundert liegen. Allein das zeigt die Sonderstellung der Edelgaschemie. Von jedem anderen Hauptgruppenelement gibt es viele Tausend Verbindungen.
Eine offene Frage ist, warum eigentlich die einfachste Xenonverbindung, nämlich Salze mit dem Kation XeH+, nicht isoliert werden konnte, wenngleich es in der Gasphase nachgewiesen werden kann. Offenbar reicht die Stärke der gegenwärtigen zur Verfügung stehenden Protonensäuren nicht aus. Immerhin konnte gezeigt werden, dass in der stärksten bekannten Säure HF/SbF5 der H2/D2 Isotopenaustausch durch Xenon gehemmt wird, d.h. dass Xenon hierbei als Base fungiert.[5]
Xenon ist ein sehr seltenes Element, es kommt in der Atmosphäre nur zu 10-5 % vor. Die gleichfalls geringe Häufigkeit von Helium (5*10-4) in der Atmosphäre ist die Folge seines geringen Atomgewichtes, so dass es laufend in den Weltraum entweicht. Dies aber kann nicht die Erklärung für die geringe Häufigkeit des Xenons sein, die nach den Theorien der stellaren Kernfusion ca. zehnmal größer sein sollte. Eine interessante Hypothese ist, dass Xenon unter hohem Druck im Erdmantel in den Silikaten chemisch gebunden sein könnte. Nicht nur die Tatsache als solche, sondern auch die Frage, in welcher Form das Xenon gebunden sein könnte, ist rein spekulativ.[6] Andererseits ist die chemische Nutzung der seltenen und damit teuren Edelgase Xenon und Krypton nicht bedrohlich, da jede ihrer Verbindungen letztlich wieder zu den Elementen zerfällt und damit in die Atmosphäre zurückgeführt wird.
[1] N. Bartlett, Proceedings Chem. Soc., London 1962, 218.
[2] J. R. DeBackere, M. R. Bortolus, G. J. Schrobilgen, Angew. Chem. Int. Ed. 2016, 55, 11917.
[3] S. Seidel. K. Seppelt, C. van Wullen, S. X. Ying, Angew. Chem. Int. Ed. 2007, 46, 6717.
[4] S. Seidel, K. Seppelt, Science 2000, 290, 117.
[5] G.A. Olah, J. Shen, J. Am. Chem. Soc. 1973, 95, 3582.
[6] C. Sanloup, B.C. Schmidt, E.M. Chamorro Perez, A, Jambon, E. Gregoryanz, M. Mohamed Mezouar, Science 2005, 310, 1174; D. S. Brock, G. J. Schrobilgen, J. Am. Chem. Soc. 2011, 133, 6265.

Prof. Dr. Konrad Seppelt
Freie Universität Berlin, Institut für Chemie und Biochemie
Das Periodensystem ist ein faszinierendes Ordnungssystem, das die Natur den Elementen gegeben hat. Vor 150 Jahren wurde dieses System erstmals von Wissenschaftlern erkannt. Die Generalversammlung der Vereinten Nationen und die UNESCO haben das Jahr 2019 daher zum International Year of the Periodic Table of Chemical Elements, dem Internationalen Jahr des Periodensystems ausgerufen. Die Elemente des Periodensystems werden in loser Folge vorgestellt.
Bildnachweis Titelbild: Alchemist-hp www.pse-mendelejew.de, Edelgase in Entladungsroehren, CC BY-SA 2.0 DE
Dieser Beitrag wurde auf FaszinationChemie erstmalig veröffentlicht am 03.06.2019

Kommentare
Dr. Marcus Wolf
am 11.12.2019Mit diesem Konzept kann man experimentell überprüfbare Arbeitshypothesen aufstellen, zum Beispiel, dass es stabile chemische Verbindungen zwischen Elementen der Neon-Gruppe und stark elektrophilen chemischen Spezies geben sollte. Stabilität einer chemischen Verbindung bedeutet, auch unter Chemikern, dass eine spektroskopische Signatur eines bindenden elektronischen Zustands beobachtet werden kann. Dabei ist es vollkommen Banane, ob dieser Zustand bei Tieftemperaturen, unter Ausschluss anderer reaktiver Spezies oder unter hohen Drücken beobachtbar wird.
Das Konzept der l-Nobilität, zusammen mit der Topologie des LSPSE, sind effektive Augenöffner für das Verständnis der chemischen Reaktivität aller chemischen Elemente. Seit mehr als 150 Jahren wird immer noch ein missverständliches Bild von "edlen" Elementen transportiert. Es ist nicht nur eine zarte Ironie, dass in der chemischen Verbindung [Au(Xe)4]2+([non-nucl.Anion]-)2 zwei der vermeintlich prototypisch "edlen" Elemente eine nacheislich kovalente chemische Bindung eingehen und das unter Bedingungen, die keinesfalls als exotisch oder als besonders anspruchsvoll bezeichnet werden können. Es entsteht der Gedanke, dass die traditionalistische Redeweise von den "Edelmetallen" oder den "Edelgasen" für den Aufbau von experimentell überprüfbaren Arbeitshypothesen in der Chemie nicht mehr weiterführt. Chemische Nobilität bleibt deswegen doch aus dem Periodischen System der Elemente verständlich, wenn man sich auf die verfügbare Topologie des LSPSE bezieht. Insofern diese Topologie die Formulierung des Periodischen Gesetzes in geschlossen analytischer Form erlaubt, darf man die Erwartung hegen, dass alle Elemente dem Periodischen Gesetz gehorchen - oder gar keines. Aus diesem Zusammenhang heraus wäre die Erforschung der Chemie der Seltenen Gase (Ne, Ar, Kr, Xe, Rn, Og) und die Erforschung der Chemie von Helium keine "Chemie für Chemiker", sondern eine fundamental legitimierte Unternehmung.