Stickstoff – unverzichtbar für Mensch, Tier und Pflanze
2019 - Jahr des Periodensystems
Stickstoff ist für das Leben auf unserem Planeten von zentraler Bedeutung. Auf alle 100 Kohlenstoffatome, die eine Zelle aufnimmt, kommen 2-20 Stickstoffatome.[1] Dabei können Verbindungen des Stickstoffs vielfältige Funktionen in biologischen Systemen erfüllen – als Rohstoff für die Biosynthese z.B. von Aminosäuren, als Botenstoff bei der physiologischen Signaltransduktion (z.B. NO)[2] oder als Oxidationsmittel in mikrobiellen Prozessen unter anoxischen Bedingungen (z.B. Nitrat).

1. Stickstoff als Ressource: Verfügbar aber unreaktiv
Somit ist es nicht überraschend, dass das Wachstum von Pflanzen und damit auch die Ernährung der Weltbevölkerung entscheidend von der Zufuhr geeigneter Stickstoffquellen abhängt. Der Name Stickstoff (vom Entdecker Carl Wilhelm Scheele auch verdorbene Luft genannt) [3] bzw. franz. Azote (vom griechischen azotikos: das Leben nicht unterhaltend) mag daher zunächst irreführend erscheinen. Er bringt zum Ausdruck, dass die häufigste Form auf unserem Planeten (ca. 50%) – der uns umgebende gasförmige Distickstoff (N2) in der Luft – chemisch äußerst reaktionsträge ist. So wird er in Laboratorien häufig als „Schutzgas“ verwendet, um unerwünschte Reaktionen von Verbindungen mit reaktiveren Bestandteilen der Luft wie Sauerstoff und Wasser zu verhindern. Die starke chemische Bindung zwischen den beiden Stickstoffatomen (945 kJ/mol) hat zur Folge, dass die N2-Spaltung in freie Stickstoffatome nur bei für Organismen unerreichbar hohen Temperaturen erfolgt. Der Schlüsselschritt im globalen Stickstoffzyklus (Abb. 1) – die Summe der biogeochemischen und anthropogenen Transformation aller atmosphärischen, terrestrischen und aquatischen stickstoffhaltigen Verbindungen – ist somit die chemische Umsetzung des N2. Und in der Tat wird in diesem Kreislauf N2 aus der Luft in Größenordnungen von mehr als 1015 g/Jahr zu chemisch reaktiverem Ammoniak (NH3), bzw. Ammonium (NH4+)„fixiert“.[4] Wie gelingt das?
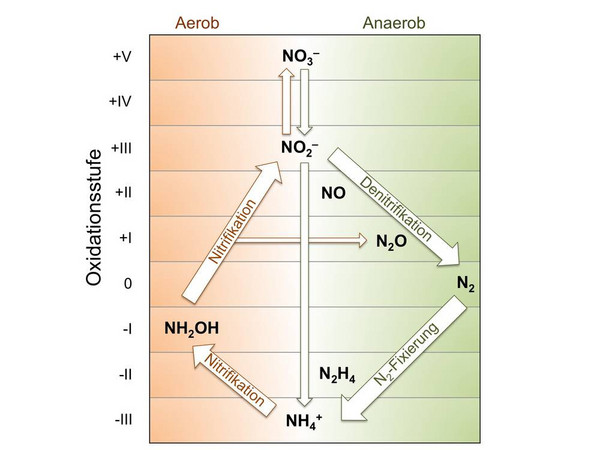
Abbildung 1. Wichtigste mikrobielle Umwandlungsprozesse im Rahmen des globalen Stickstoffzyklus. Quelle: D. E. Canfield, A. N. Glazer, P. G. Falkowski Science 2010, 330, 192.
2. Biologische Stickstofffixierung: Die Evolution der Biokatalyse
In der präbiotischen Welt beruhte die chemische Umwandlung von atmosphärischem N2, z.B. in NO, vor allem auf Hochenergieprozessen wie Blitzschlag oder Meteoriteneinschlägen. Bereits zu einem frühen Zeitpunkt der Evolution entstand aber ein faszinierendes Werkzeug, dass es prokaryotischen Mikroorganismen ermöglichte, N2 zu Ammoniak zu reduzieren. Das Enzym Nitrogenase katalysiert diese Reaktion unter Umgehung von Reaktionswegen, welche die Spaltung in freie Stickstoffatome erfordern. Damit gelingt die „Stickstofffixierung“ zwar bei Umgebungstemperatur, erfordert aber noch immer einen großen Energieaufwand: Pro umgesetztem Molekül N2 werden 16 Äquivalente Adenosintriphosphat (ATP) – der universelle, molekulare Energieträger der Zellen – verbraucht, und Wasserstoff entsteht als Nebenprodukt (Abb. 2).[5]
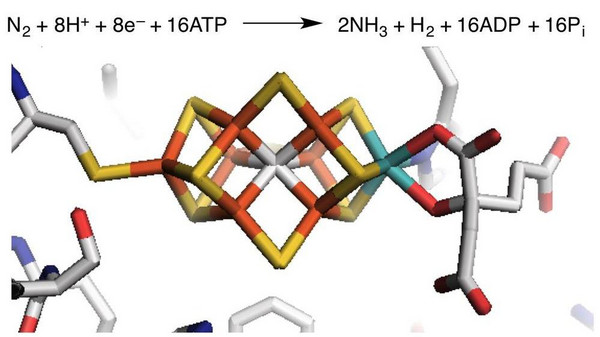
Die effizienteste Nitrogenase enthält einen eisen- und molybdänhaltigen Kofaktor, an dem die chemische N2-Transformation stattfindet. Intensive Forschung über diese [FeMo]-Nitrogenase haben zu einem besseren, aber noch immer nicht vollständigen Verständnis der komplexen Sequenz von Einzelschritten geführt, nach denen die Gesamtreaktion abläuft.[6] Und selbst die Struktur des Kofaktors – ein einzigartiger Cluster aus sieben Eisen-, einem Molybdän-, neun Schwefel- und einem Kohlenstoffatom – wurde erst 2011 vollständig aufgeklärt (Abb. 2).[7] Nach gegenwärtigem Stand der Forschung wird das N2-Molekül zunächst an einem Eisenatom gebunden und dann schrittweise die sechs Elektronen und Protonen auf den Stickstoff übertragen. Der Kofaktor ermöglicht die Reaktion durch Stabilisierung der NxHy-Intermediate.
Die evolutionsbiologische Bedeutung der Nitrogenase für die Entstehung des Lebens und der hohe energetische Preis für den Rohstoff NH3 spiegeln sich auch in der Entstehung der [FeMo]-Nitrogenase wieder.[8] Neben dieser sind zwei weitere Formen bekannt, in denen das Molybdän durch Vanadium bzw. ein weiteres Eisenatom ausgetauscht sind. Diese älteren Enzyme sind jedoch weniger aktive Katalysatoren. Vor etwa 2,5 Milliarden Jahren begann durch Photosynthese betreibende Mikroorganismen die Konzentration von Sauerstoff in der Atmosphäre bis auf den heutigen Stand zu steigen. Dieser Wechsel zu oxidierenden Bedingungen führte zum Abfall der Eisenkonzentration in den Ozeanen nach Oxidation von Fe2+-Ionen in weniger wasserlösliches Fe3+. Im Gegenzug stieg die Konzentration von gelöstem Molybdän als lösliches MoO42–. Die geringere Verfügbarkeit von Eisen wurde somit durch die Entstehung der aktiveren [FeMo]-Nitrogenase ausgeglichen. Die Nitrogenase dokumentiert somit beispielhaft den evolutionären Druck, welchen die Verfügbarkeit von essentiellen Elementen auf Organismen ausübt.
3. Technische Stickstofffixierung: Die Drosophila der heterogenen Katalyse
Auch für die moderne, industrialisierte Gesellschaft spielt die Ammoniaksynthese eine entscheidende Rolle. Die industriellen Verfahren für die Synthese stickstoffhaltiger Mineraldünger waren Voraussetzung für die Vervierfachung der Weltbevölkerung im 20. Jahrhundert. Die Grundlage dazu bildet das Haber-Bosch-Verfahren – die Hochdrucksynthese von NH3 aus elementarem Stickstoff und Wasserstoff – das mittlerweile zur Vergabe von drei Nobelpreisen führte – an Fritz Haber (1919) für die Entwicklung des Katalysators, an Carl Bosch (1931) für die technische Realisierung und an Gerhard Ertl (2007) für die Aufklärung des Reaktionsmechanismus (Abb. 3).
Abbildung 3 (unten). Protagonisten der Stickstofffixierung: Fritz Haber (links), Carl Bosch (Mitte) und Gerhard Ertl (rechts). (Fotos: links, The Nobel Foundation, Fritz Haber, als gemeinfrei gekennzeichnet, Mitte: Nobel Foundation, Carl Bosch, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons), rechts; Wolfram Däumel, Prof Ertl-Portrait, CC BY-SA 2.0 DE
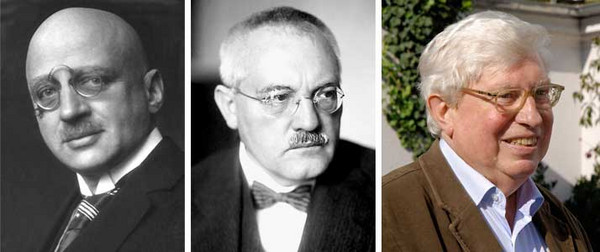
Die direkte Reaktion von N2 und H2 ist bei Raumtemperatur unmessbar langsam und benötigt daher sehr hohe Reaktionstemperaturen. Unter diesen Bedingungen ist aber die Ausbeute an Ammoniak sehr niedrig. Dieses Paradoxon löste Haber 1908 durch die Entwicklung von Katalysatoren, welche die Reaktion bei technisch realisierbaren Bedingungen (ca. 500°C und 300 bar) und mit brauchbaren Ausbeuten (ca. 20%) ermöglichen. Auch die modernen technischen Katalysatoren basieren auf dem Metall Eisen. Sie werden aus Magnetitpartikeln (Fe3O4) und weiteren Zuschlägen (CaO, Al2O3, K2O, SiO2) durch Einwirkung von Wasserstoff im Reaktor zu einem komplexen, nanostrukturierten Feststoff umgewandelt, dessen lokale Struktur der von reinem Eisen ähnelt, aber auf größeren Längenskalen deutliche Unterschiede zeigt.[9] Trotz des komplexen Katalysatoraufbaus sind die Elementarschritte der Reaktion heute sehr gut verstanden – im Gegensatz zu vielen anderen katalysierten industriellen Prozessen, deren Entwicklung noch immer im Wesentlichen empirisch getrieben ist. Die Ammoniaksynthese fungiert somit auch als „Drosophila der Katalyse“, an der neue, rationale Konzepte der Katalyseforschung getestet und etabliert werden.
Neben der wissenschaftlichen Bedeutung sind besonders die Größenordnungen des industriellen Verfahrens beeindruckend: Ca. 160 Mio t Ammoniak wurden 2010 so hergestellt und verbrauchten etwa 1-2 % des Weltenergiebedarfs, vor allem für die Herstellung des Wasserstoffs aus Erdgas. Vier Fünftel davon gehen in die Düngemittelproduktion, von der die Ernährung etwa der halben Weltbevölkerung direkt abhängt. Das Haber-Bosch-Verfahren und die Biografie des Fritz Haber zeigen aber auch beispielhaft die Ambivalenz des industriellen Fortschritts und die Verantwortung der modernen Wissenschaft. So wären die großen Kriege des 20. Jahrhunderts ohne großtechnische Herstellung von Ammoniak und daraus von Nitraten nicht möglich gewesen. Und schließlich hat der immense, anthropogene Eintrag von Ammoniak in die Biosphäre Auswirkungen auf den globalen Stickstoffzyklus. Denn die unvollständige Verwertung von Mineraldüngern durch die gängigsten Nutzpflanzen (Weizen, Reis, Mais) führt zur erhöhten Freisetzung von Nitrat in die aquatische Umwelt und des sehr potenten Treibhausgases N2O in die Atmosphäre durch mikrobielle Nitrifizierung (Abb. 1).[4]
4. Stickstofffixierung: Quo Vadis?
Die Faszination für die Stickstofffixierung als eine der zentralen Reaktionen für das Leben wie auch als wissenschaftliche Herausforderung ist 100 Jahre nach der Entwicklung des Haber-Bosch-Verfahrens ungebrochen. Aktivere Katalysatoren könnten höhere Ausbeuten bei niedrigeren Temperaturen und Drücken ermöglichen. In dieser Hinsicht ist die Nitrogenase noch immer das Maß aller Dinge. Biomimetische Modellsysteme ermöglichten bereits die Ammoniaksynthese bei Normaldruck und Umgebungstemperatur, aber deren Effizienz bleibt noch immer weit hinter dem natürlichen System und dem technischen Verfahren zurück.[10] Weitergehende Ansätze jenseits des NH3, wie die direkte Verwendung von N2 als Stickstoffquelle für organische Moleküle, sind ebenso Gegenstand aktueller Forschung (Abb. 4).
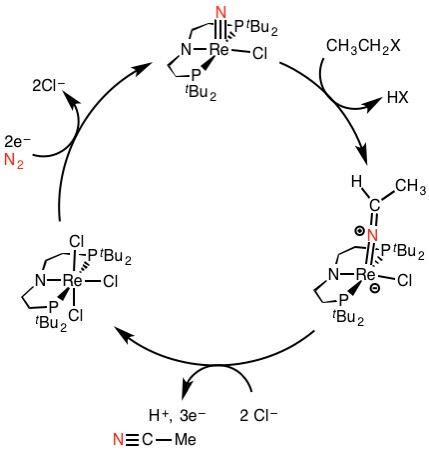
Schließlich ist auch die Rückreaktion der Stickstofffixierung von Interesse: Die gut ausgebaute Infrastruktur zur Herstellung und Distribution qualifizieren den Ammoniak auch als interessantes Molekül für die chemische Energiespeicherung.[11] Durch katalytische Zersetzung kann dann der viel schwieriger zu lagernde Wasserstoff wieder freigesetzt und direkt einer Brennstoffzelle zur Stromerzeugung zugeführt werden. Einziges „Abfallprodukt“ dieses stickstoffbasierten Energiespeicherungskonzepts wäre wiederum: Stickstoff.
Literatur
R. W. Steiner, J. J. Elser, Ecological Stoichiometry: The Biology of the Elements from Molecules to the Biosphere, Princeton University Press, 1997.
Carl Wilhelm Scheele, Chemische Abhandlung von der Luft und dem Feuer, S. L. Crusius, 1777.
D. E. Canfield, A. N. Glazer, P. G. Falkowski Science 2010, 330, 192.
B. K. Burgess, D. J. Lowe Chem. Rev. 1996, 96, 2983.
B. M. Hoffman, D. Lukoyanov, Z.-Y. Yang, D. R. Dean, L. C. Seefeldt Chem. Rev. 2014, 114, 4041.
a) K. M. Lancaster, M. Roemelt, P. Ettenhuber, Y. Hu, M. W. Ribbe, F. Neese, U. Bergmann, S. DeBeer Science2011, 334, 974; b) T. Spatzal, M. Aksoyoglu, L. Zhang, S. L. A. Andrade, E. Schleicher, S. Weber, D. C. Rees, O. Einsle Science 2011, 334, ?940. ?
A. D. Anbar, A. H. Knoll Science 2002, 297, 1137.
R. Schlögl Angew. Chem. 2003, 115, 2050.
H.-P. Jia, E. A. Quadrelli Chem. Soc. Rev. 2014, 43, 547.
F. Schüth, R. Palkovits, R. Schlögl, D. S. Su Energy Environ. Sci. 2012, 5, 6278.

Prof. Dr. Sven Schneider
Institut für Anorganische Chemie, Georg-August-Universität Göttingen
Das Periodensystem ist ein faszinierendes Ordnungssystem, das die Natur den Elementen gegeben hat. Vor 150 Jahren wurde dieses System erstmals von Wissenschaftlern erkannt. Die Generalversammlung der Vereinten Nationen und die UNESCO haben das Jahr 2019 daher zum International Year of the Periodic Table of Chemical Elements, dem Internationalen Jahr des Periodensystems ausgerufen. Die Elemente des Periodensystems werden in loser Folge vorgestellt.
Bildnachweis Abb. Seitenanfang: Jeffrey M. Vinocur, Liquid nitrogen tank, CC BY-SA 3.0


Kommentare
Toka
am 06.11.2022was denken Sie darüber?
kjs (Redaktion)
am 07.11.2022