Schwefel: Ringe, Ketten, Farben

2019 – Jahr des Periodensystems
Würde man auf der Straße Passanten bitten, ihnen bekannt chemische Elemente zu nennen, dann wäre das Element Schwefel ganz weit oben auf der Liste. Das liegt zum einen sicherlich daran, dass Schwefel eines der wenigen chemischen Elemente ist, das gediegen, also in elementarer Form, in der Natur vorkommt und deshalb schon seit Urzeiten der Menschheit bekannt ist (Abb.1). Zum anderen hat es das Element Schwefel geschafft, Bestandteil umgangssprachlicher Redewendungen wie „es stinkt nach Schwefel“ oder „Zusammenhalten wie Pech und Schwefel“ zu werden. Neben dem unangenehmen Geruch vieler chemischer Verbindungen des Schwefels, haben auch Umweltprobleme wie der saure Regen, der durch die Emission von Schwefeldioxid (SO2) verursacht wurde, zum schlechten Ruf des Schwefels beigetragen. Diese Probleme aber dem Element Schwefel selbst in die Schuhe zu schieben wäre sicherlich nicht fair. Immerhin ist elementarer Schwefel bei Standardbedingungen ein gelber Feststoff, der ungiftig und geruchslos ist. Zudem ist Schwefel einer der wichtigsten Ausgangsstoffe für die Chemische Industrie. Im Gegensatz zu vielen Elementen, die auf der Erde zunehmend rar werden bzw. deren Abbau einen immer größeren Aufwand erfordert, fällt Schwefel in großen Mengen bei der Erdölentschwefelung als Nebenprodukt an, wovon ca. 90 % zu Schwefelsäure (H2SO4) umgesetzt werden. Deren Weltjahresproduktion liegt bei ca. 200 Mio Tonnen und damit ist Schwefelsäure eine der wichtigsten Grundchemikalien überhaupt. Die Anwendungen von Schwefel sind äußerst vielseitig. Als die bekanntesten seien nur das Vulkanisieren von Kautschuk und die Herstellung von Zündhölzern genannt. Aktuelle wissenschaftliche Untersuchungen beschäftigen sich unter anderem mit der Natrium-Schwefel-Batterie zur Energiespeicherung. Auch der menschliche Organismus kommt nicht ohne Schwefel aus, so beträgt die täglich aufgenommene bzw. ausgeschiedene Menge an Schwefel ca. 1000 mg.

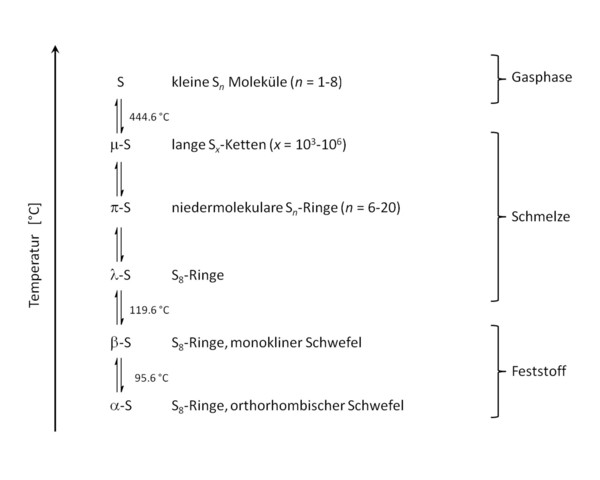
Aus anorganisch-chemischer Sicht ist besonders bemerkenswert, dass Schwefel wie kein anderes chemisches Element in der Lage ist, homoatomare ketten- und ringförmige Moleküle zu bilden. Der Begriff „homoatomar“ bedeutet, dass ein Molekül nur aus Atomen eines einzigen chemischen Elements besteht. Die bei Raumtemperatur thermodynamisch beständigste Form ist der feste gelbe orthorhombische a-Schwefel, der aus kronenförmigen S8-Molekülen aufgebaut ist. Bei 95.5 °C wandelt sich dieser in den monoklinen b-Schwefel um, der ebenfalls aus S8-Molekülen besteht, die aber in dieser Form etwas weniger dicht gepackt sind. Das Auftreten von verschiedenen Kristallstrukturen mit identischer chemischer Zusammensetzung nennt man Polymorphie. Auch die Ringgröße der Schwefelmoleküle kann variieren, man spricht dann von verschiedenen Allotropen des Schwefels. Tatsächlich ist Schwefel das Element, welches die größte Anzahl verschiedener allotroper Modifikationen aufweist. Bisher sind Ringgrößen von 6 bis 20 gezielt synthetisiert und auch strukturell charakterisiert worden.
Ab 119.6 °C schmilzt Schwefel und neben S8-Molekülen liegen dann auch die anderen Ringgrößen im Gleichgewicht in der gelben und dünnflüssigen Schmelze vor. Widererwarten wird die Schmelze beim weiteren Erhitzen dickflüssiger. Dieses ist mit dem Aufbrechen der Ringe und der Bildung von längeren Ketten zu erklären, die sich ineinander verweben können und so die Viskosität der Schmelze erhöhen. Erst kurz unterhalb des Siedepunktes bei 444.6 °C ist die Schmelze dann wieder dünnflüssiger, was auf das Aufbrechen der langen Schwefelketten hindeutet. In der Gasphase liegen dann, abhängig von der Temperatur, kleine Moleküle mit acht oder weniger Schwefelatomen vor. Dieses Schmelzverhalten ist einmalig im Periodensystem der Elemente und zeigt die faszinierende Vielfalt homoatomarer Schwefelverbindungen auf (Abb. 2).
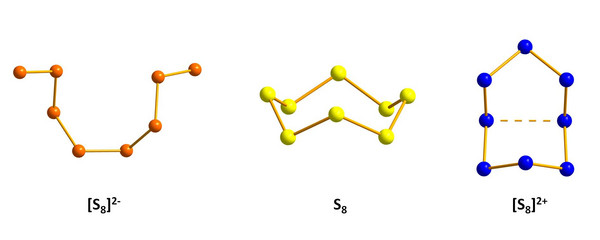
Es sind aber nicht nur neutrale homoatomare Schwefelmoleküle bekannt. Der Schwefel gehört auch zu den wenigen chemischen Elementen, die sowohl positiv als auch negativ geladene homopolyatomare Ionen bilden können (Abb. 3). Durch Reduktion von Schwefel mit Alkalimetallen entstehen abhängig von der Stöchiometrie und den Reaktionsbedingungen gefärbte anionische Polysulfide ([Sn]2-), die aus Ketten von n Schwefelatomen (n = 2-8) bestehen.[1] Diese Polysulfide sind, eingelagert in Mineralien, für deren Farbe verantwortlich, z.B. für die blaue Farbe vom Ultramarin.
Homoatomare Schwefelkationen können durch Oxidation von Schwefel in supersauren Lösungsmitteln erhalten werden.[2] So wurde bereits 1804 beobachtet, dass beim Lösen von Schwefel in Oleum (rauchende Schwefelsäure) tief gefärbte Lösungen entstehen. Mittlerweile ist dieses Gebiet sehr intensiv untersucht worden, aber noch weit davon entfernt, vollständig verstanden zu sein. Aus solchen supersauren Systemen konnten die homoatomaren Schwefelkationen [S4]2+ (farblos), [S8]2+ (blau ?) und [S19]2+ (rot) in Form entsprechender Salze isoliert und strukturell charakterisiert werden. Neben den Dikationen liegen in komplizierten Gleichgewichten auch noch mindestens drei verschiedene homoatomare Schwefelradikalkationen vor. Neben dem schon länger bekannten [S5]+ konnte erst kürzlich das homoatomare Schwefelkation [S8]+, welches den ersten Schritt der Oxidation von elementarem Schwefel darstellt, eindeutig identifiziert werden.[3]
Zusammenfassend lässt sich festhalten, dass die Strukturvielfalt homoatomarer Schwefelverbindungen, sei es neutral, anionisch oder kationisch, ohne Beispiel ist. Oftmals liegen in Lösung komplexe Gleichgewichte vor, so dass die Zuordnung der beobachteten intensiven Farben zu bestimmten Verbindungen sehr schwierig ist. Es kann in der Zukunft erwartet werden, dass die Chemie des Schwefels noch weitere faszinierende Entdeckungen preisgibt.

Prof. Dr. Carsten Jenne
Fakultät für Mathematik und Naturwissenschaften, Anorganische Chemie
R. Steudel, Inorganic Polysulfides Sn2- and Radical Anions Sn-. In Topic in Current Chemistry, (R. Steudel, Ed.) Springer: Berlin / Heidelberg, 2003, Vol. 231, pp 127-152.
I. Krossing, Homoatomic Sulfur Cations. In Topic in Current Chemistry, (R. Steudel, Ed.) Springer: Berlin / Heidelberg, 2003; Vol. 230, pp 79-92.
J. Derendorf, C. Jenne, M. Keßler, Angew. Chem. Int. Ed. 2017, 56, 8281-8284; Angew. Chem. 2017, 129, 8395 –8398.
Das Periodensystem ist ein faszinierendes Ordnungssystem, das die Natur den Elementen gegeben hat. Vor 150 Jahren wurde dieses System erstmals von Wissenschaftlern erkannt. Die Generalversammlung der Vereinten Nationen und die UNESCO haben das Jahr 2019 daher zum International Year of the Periodic Table of Chemical Elements, dem Internationalen Jahr des Periodensystems ausgerufen. Die Elemente des Periodensystems werden in loser Folge vorgestellt.
Foto Titelbild: James Shook (=JShook), Sulpherous fumeroles, White Island, New Zealand, CC BY-SA 3.0
Dieser Beitrag wurde auf FaszinationChemie erstmalig veröffentlicht am 30.01.2019

Kommentare
Keine Kommentare gefunden!